
【题目】下表列出了①⑤五种元素在周期表中的位置:

请按要求回答下列问题:
(1)元素④的原子结构示意图为______.
(2)元素①单质的电子式为______.
(3)元素②⑤的原子半径由大到小的顺序为(填元素符号)______,它们的最高价氧化物对应的水化物中,酸性最强的是______(填化学式).
(4)元素②的单质在氧气中燃烧的产物与二氧化碳反应的化学方程式为______;元素③的最高价氧化物与烧碱溶液反应的离子方程式为______.
【答案】![]()
![]() Na>Si>S>Cl HClO4 2Na2O2+2CO2=2Na2CO3+O2 SiO2+2OH=SiO23+H2O
Na>Si>S>Cl HClO4 2Na2O2+2CO2=2Na2CO3+O2 SiO2+2OH=SiO23+H2O
【解析】
根据元素在元素周期表中的位置,①⑤分别是N、Na、Si、S、Cl。
(1)元素④是S,核外有16个电子,S原子结构示意图为![]() ;
;
(2)元素①是N,单质为N2,氮原子间有3对共用电子,电子式为![]() ;
;
(3)同周期元素从左到右半径减小,元素②⑤的原子半径由大到小的顺序为Na>Si>S>Cl;同周期元素从左到右非金属性增强,非金属性越强,最高价氧化物对应的水化物酸性越强,酸性最强的是HClO4。
(4)元素②的单质是金属钠,钠在氧气中燃烧的产物是过氧化钠,过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应化学方程式为2Na2O2+2CO2=2Na2CO3+O2;元素③是硅,二氧化硅与氢氧化钠反应生成硅酸钠和水,离子方程式为SiO2+2OH=SiO32+H2O。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】己知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
N2(g)+3H2(g)![]() 2NH3(g)△H=-92.60kJ/mol
2NH3(g)△H=-92.60kJ/mol
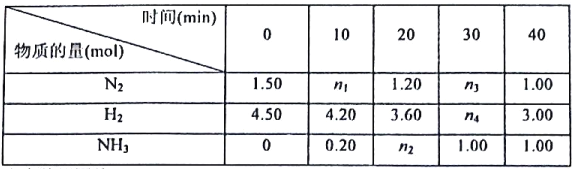
根据表中数据回答:
(1)反应进行到20min时放出的热量为__________kJ。
(2)0-10min内的平均反应速率v(N2)为__________mol/(L·min)
(3)此温度下该逆反应的化学平衡常数K(逆)=__________(保留两位小数).
(4)反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将__________(填“正向移动”或“逆向移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿 (主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
Ⅰ.“酸浸”
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为______、______;滤渣A的主要成分为_______。

(2)Co2O3与浓硫酸反应生成CoSO4,化学方程式为__________________
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12离子方程式为__________________。
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol/L)时,c(Ca2+)=__________(两位有效数字,Ksp(MgF2)=7.4×10-11,Ksp(CaF2)=1.5×10-10)
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为___________
Ⅲ.“萃取和反萃取”
(6)“水相C”中的主要溶质是Na2SO4和________(写化学式)。
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol/L的CoCl2溶液5L,忽略损耗,钴的产率=____(产率=产物中元素总量/原料中该元素总量×100%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
A. 单位时间内生成n mol O2 的同时,生成2n molNO2 B. 混合气体的平均相对分子质量不再改变
C. 混合气体的颜色不再改变 D. NO2, NO, O2的速率之比是2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
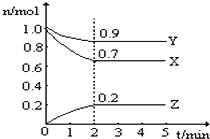
(1)该反应的化学方程式为_______________________
(2)从开始至2min,Z的平均反应速率为___________
(3)其他条件不变,升高温度,逆反应速率将________(填“加快”、“减慢”或“不变”)。
(4)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/S |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究 ______ 、 ______ 对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明 ______ ,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法错误的是( )
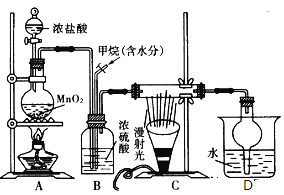
A. 实验时先点燃A处酒精灯再通甲烷
B. 装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
C. 装置C经过一段时间的强光照射后,生成的有机物有4种
D. 从D中分离出盐酸的方法为过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com