
����Ŀ���ܱ���Ϊս�����ʣ��г�ɫ�����ܺ㷺��Ӧ�á���ˮ�ܿ� (��Ҫ�ɷ�ΪCo2O3��CoO��CuO��Fe2O3��CaO��MgO��NiO��SiO2��)Ϊԭ���Ʊ�CoCl2��6H2O�Ĺ���������ͼ��ʾ:

�ش���������:
��.�������
��1���ܵĽ����������ʱ�䡢�¶ȵı仯��ϵ����ͼ��ʾ���ۺϿ��dzɱ���Ӧѡ�����ѹ�������Ϊ______��______������A����Ҫ�ɷ�Ϊ_______��

��2��Co2O3��Ũ���ᷴӦ����CoSO4����ѧ����ʽΪ__________________
��.���������ӡ������������
��3����������������Na2SO4���壬��������ɫ�����������Na2Fe6(SO4)4(OH)12���ӷ���ʽΪ__________________��
��4�����ơ�þ����������NaF����Mg2+ǡ����ȫ����ȥ(����Ũ�ȵ���10-5mol/L)ʱ��c(Ca2+)=__________(��λ��Ч���֣�Ksp(MgF2)=7.4��10-11��Ksp(CaF2)=1.5��10-10��
��5����ͭ����������Na2S2O3��������Ӧ2CuSO4+2Na2S2O3+2H2O=Cu2S��+S��+2Na2SO4+2H2SO4���÷�Ӧ�Ļ�ԭ����Ϊ___________
��.����ȡ�ͷ���ȡ��
��6����ˮ��C���е���Ҫ������Na2SO4��________(д��ѧʽ)��
��7��ʵ���ҳ�ȡ100gԭ��(����11.80%)������ȡʱ�õ�Ũ��Ϊ0.036mol/L��CoCl2��Һ5L��������ģ��ܵIJ���=____(����=������Ԫ������/ԭ���и�Ԫ��������100%)��
���𰸡�90�� 12h SiO2������������� 2Co2O3+4H2SO4��Ũ��![]() 4CoSO4+4H2O+O2�� 2Na++6Fe3++4SO42-+12H2O
4CoSO4+4H2O+O2�� 2Na++6Fe3++4SO42-+12H2O![]() Na2Fe6(SO4)4(OH)12��+12H+ 2.0��10��5mol/L S��Cu2S NiSO4 90%
Na2Fe6(SO4)4(OH)12��+12H+ 2.0��10��5mol/L S��Cu2S NiSO4 90%
��������
��1����ͼ���֪����ѽ����¶�Ϊ90�棬����ѽ���ʱ��Ϊ12h��ˮ�ܿ���Ҫ�ɷ���SiO2����������в����ܽ⣬��������A����Ҫ�ɷ�ΪSiO2��
��2�����ݵ����غ�д���÷�Ӧ�Ļ�ѧ����ʽ��
��3������ԭ���غ�͵���غ��д����Ӧ�����ӷ���ʽΪ��2Na++6Fe3++4SO42-+12H2O![]() Na2Fe6(SO4)4(OH)12��+12H+��
Na2Fe6(SO4)4(OH)12��+12H+��
��4������c(Ca2+)/c(Mg2+)=Ksp��CaF2��/Ksp��MgF2�������c(Ca2+)��
��5������ͭ��CuԪ�صĻ��ϼ���+2�۱�Ϊ+1�ۣ����ϼ۽��ͣ�Na2S2O3��һ����S�Ļ��ϼ۽��ͣ�ת��ΪS��Cu2S�е�S������ԭ������S��Cu2S��
��6���������̵�Ŀ���Լ���Ҫ�ɷ֣��Ƴ�ˮ��C�к��е���Ҫ������Na2SO4��NiSO4��
��7�����ݲ��ʵĹ�ʽ���м��㡣
��1����ͼ��֪�������¶ȣ��ܵĽ��������������60��ʱ����Ч��̫�ͣ�90��ʱ������Ч����100��ʱ������Ч�������ԣ�����100��ʱ�����ɱ�ԶԶ����90��ʱ�����ɱ��������ѽ����¶�Ϊ90�棬����ѽ���ʱ��Ϊ12h��ˮ�ܿ���Ҫ�ɷ���SiO2����������в����ܽ⣬��������A����Ҫ�ɷ�ΪSiO2���ʴ�Ϊ��90�桢12h��SiO2���������������
��2��Co2O3��Ũ���ᷴӦ����CoSO4����֪Co2O3�������������ϼ����߱�������Ԫ��ΪO��-2�۵�����������O2�����ݵ����غ�д���÷�Ӧ�Ļ�ѧ����ʽΪ��
2Co2O3+4H2SO4��Ũ��![]() 4CoSO4+4H2O+O2�����ʴ�Ϊ��2Co2O3+4H2SO4��Ũ��
4CoSO4+4H2O+O2�����ʴ�Ϊ��2Co2O3+4H2SO4��Ũ��![]() 4CoSO4+4H2O+O2����
4CoSO4+4H2O+O2����
��3����������Na2SO4���壬��������ɫ�����������Na2Fe6(SO4)4(OH)12������ԭ���غ�͵���غ��д����Ӧ�����ӷ���ʽΪ��2Na++6Fe3++4SO42-+12H2O![]() Na2Fe6(SO4)4(OH)12��+12H+���ʴ�Ϊ��2Na++6Fe3++4SO42-+12H2O
Na2Fe6(SO4)4(OH)12��+12H+���ʴ�Ϊ��2Na++6Fe3++4SO42-+12H2O![]() Na2Fe6(SO4)4(OH)12��+12H+��
Na2Fe6(SO4)4(OH)12��+12H+��
��4��c(Ca2+)/c(Mg2+)=[c(Ca2+)c2(F��)]/[c(Mg2+)c2(F��)]=Ksp��CaF2��/Ksp��MgF2��=(1.5��10��10)/(7.40��10��11)��c(Mg2+)=10-5mol/L���빫ʽ�����c(Ca2+)=2.0��10��5mol/L���ʴ�Ϊ��2.0��10��5mol/L��
��5����ԭ����������������ԭ�ó������ʣ����ݻ�ѧ��Ӧ����ʽ������ͭ��CuԪ�صĻ��ϼ���+2�۱�Ϊ+1�ۣ����ϼ۽��ͣ�Na2S2O3��һ����S�Ļ��ϼ۽��ͣ�ת��ΪS��Cu2S�е�S������ԭ������S��Cu2S���ʴ�Ϊ��S��Cu2S��
��6���������̵�Ŀ���Լ���Ҫ�ɷ֣��Ƴ�ˮ��C�к��е���Ҫ������Na2SO4��NiSO4���ʴ�Ϊ��NiSO4��
��7�����ݲ��ʵĹ�ʽ���ó��ܵIJ���Ϊ0.036mol/L��5L��59g/mol/��100g��11.80%����100%=90%���ʴ�Ϊ��90%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����һ���ݻ�Ϊ2L���ܱ������У�X��Y��Z���������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
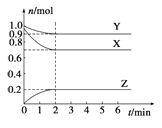
��1���÷�Ӧ�Ļ�ѧ����ʽΪ_______________��
��2����Ӧ��ʼ��2min������Z�ķ�Ӧ����Ϊ_____________��
��3����X��Y��Z��Ϊ���壬��Ӧ��ƽ��ʱ����ѹǿ�ǿ�ʼʱ��_______����������ʱ�������������СΪԭ����0.5������ƽ��ʱ���������¶Ƚ����ͣ����������������Ƚ���������÷�Ӧ������ӦΪ_________��Ӧ������ȡ������ȡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���֪��NaClO2������Һ���¶ȵ���38��ʱ��������NaClO2��3H2O���¶ȸ���38��ʱ��������NaClO2���¶ȸ���60��ʱNaClO2�ֽ�����NaClO3��NaCl,��һ�������������¡�
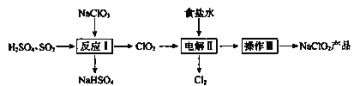
��ش��������⣺
(1)NaClO2��ClԪ�صĻ��ϼ�Ϊ____________��
(2)��ӦI��
��SO2��___________(�����������ԭ����)��
��д����ӦI�Ļ�ѧ����ʽ��__________________________��
(3)���II��
������ʳ��ˮ�ɴ���ˮ���ƶ��ɣ�����ʱ��Ϊ��ȥ����ˮ�е�Mg2+��Ca2+����Ҫ������Լ��ֱ�Ϊ_______��______��
�ڵ������б�������������________��
�ۿ���NaOH��Һ���յ�������Cl2����Ӧ�����ӷ���ʽ��______________��
(4)����III��
��Һ����NaClO2�IJ������裺�ټ����������ڳ��ȹ��ˣ���ϴ�ӣ��ܸ���õ���Ʒ�����ȹ���Ӧ���Ƶ��¶ȷ�Χ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�Ա�����ȲΪԭ�Ϻϳɻ���ԭ��E��·�����£�
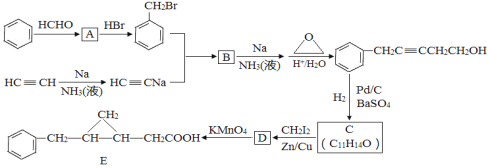
�ش��������⣺
��1��A������___________________��
��2������B�Ļ�ѧ����ʽΪ____________________________����Ӧ������________��
��3��C�Ľṹ��ʽΪ____________��C�ķ�����һ�������̼ԭ�������_____����
��4����Dͬ������ж�����Ԫ���ṹ�����뻷֮���õ������ӣ���ͬ���칹����______�֣�����д����ͬ���칹��Ľṹ��ʽ��_____________________________��
��5�����������ϳ�·�ߣ����һ������Ȳ�ͱ�Ҫ�Լ��ϳɻ������·�ߣ�_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܼ�����ػ�������;�dz��㷺���ش���������:
��1����̬Coԭ�Ӽ۵��ӹ���Ų�ʽΪ________�����ĵ�����I4(Co) < I4(Fe)����ԭ����______________________________��Co ��Caͬ������������������ͬ�������ܵ��۷е���ȸƴ���ԭ����___________________________________________________.
��2������������ʯ�Ҽ��Ȳ���֮һΪCaS3��S32-�ļ�����״��_______������ԭ���ӻ���ʽ��_______�����以Ϊ�ȵ�����ķ�����_______ (��1��)��
��3��K ��Naλ��ͬ���壬K2S���۵�Ϊ840�棬Na2S���۵�Ϊ950�棬ǰ���۵�ϵ͵�ԭ����___________________________________________________________________ ��
��4��S��O��Se��Teλ��ͬһ���壬���ǵ��⻯��ķе���ͼ��ʾ���е㰴ͼ����ʾ��Ϊ��ԭ����_______ ��

��5���ܵ�һ�ֻ����ᄃ���ṹ����ͼ��ʾ��

����֪A���ԭ���������ΪΪ(0��0��0)��B��Ϊ(1/2��0��1/2)����C���ԭ���������Ϊ_____��
����֪��������Ϊa=0.5485nm����þ�����ܶ�Ϊ_____g/cm3(�г��������ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��P4(g)��6Cl2(g)===4PCl3(g) ��H��a kJ��mol��1��
P4(g)��10Cl2(g)===4PCl5(g) ��H��b kJ��mol��1��
��֪�γɻ��1 mol��ѧ���ų������յ�������Ϊ�û�ѧ���ļ��ܡ�P4������������ṹ��PCl5��P��Cl���ļ���Ϊc kJ��mol��1��PCl3��P��Cl���ļ���Ϊ1.2c kJ��mol��1������������ȷ����
A. P��P���ļ��ܴ���P��Cl���ļ���
B. ����Cl2(g)��PCl3(g)===PCl5(s)�ķ�Ӧ����H
C. Cl��Cl���ļ���Ϊ(b��a��5.6c)/4 kJ��mol��1
D. P��P���ļ���Ϊ(5a��3b��12c)/8 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��г��ˢ�������Ԫ�������ڱ��е�λ�ã�

�밴Ҫ��ش��������⣺
(1)Ԫ�آܵ�ԭ�ӽṹʾ��ͼΪ______.
(2)Ԫ�آٵ��ʵĵ���ʽΪ______.
(3)Ԫ�آ�����ԭ�Ӱ뾶�ɴ�С��˳��Ϊ(��Ԫ�ط���)______,���ǵ�����������Ӧ��ˮ������,������ǿ����______(�ѧʽ).
(4)Ԫ�آڵĵ�����������ȼ�յIJ����������̼��Ӧ�Ļ�ѧ����ʽΪ______��Ԫ�آ۵�������������ռ���Һ��Ӧ�����ӷ���ʽΪ______.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������ĵ���ƽ�ⳣ�����±���ʾ:
���� | ���� | ������ | ̼�� | ������ |
����ƽ�ⳣ��Ka(25��) | 1.75��10-5 | 2.98��10-8 | Ka1=4.3��10-7 Ka2=5.61��10-11 | Ka1=1.54��10-7 Ka2=1.02��10-7 |
�������ӷ���ʽ��ȷ����
A. ������CO2ͨ��NaClO��Һ��:CO2+H2O+2C1O-==CO32-+2HClO
B. ������SO2ͨ��Na2CO3��Һ��:SO2+H2O+2CO32-==SO32-+2HCO3-
C. ������SO2ͨ��Ca(ClO)2��Һ��:SO2+H2O+Ca2++2ClO-==CaSO3��+2HClO
D. ��ͬŨ�ȵ�NaHCO3��Һ��NaHSO3��Һ��������:H++HCO3-==CO2��+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com