
【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O
【答案】B
【解析】酸的电离平衡常数:![]() ,
,
则酸性:![]()
A.少量的CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+ClO-=HCO3-+HClO,A错误;B.少量的SO2通入Na2CO3溶液中:离子方程式为:SO2+H2O+2CO32-=SO32-+2HCO3-,B正确;C.二氧化硫具有还原性,次氯酸根离子具有氧化性,二者能发生氧化还原反应生成硫酸根离子和氯离子,所以少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++ClO-=CaSO4↓+Cl-+2H+,C错误;D.相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合的离子方程式为HSO3-+HCO3-=CO2↑+H2O+SO32-,D错误;答案选B.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质的比较顺序中,不正确的是![]()
A. 热稳定性:HF<HCl<HBr<HI B. 微粒半径:K+>Na+>Mg2+>Al3+
C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3 D. 最外层电子数:Li<Mg<Si<Ar
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,在850℃时,平衡常数K=1.现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
(1)达平衡时,CO转化率为多少?
(2)H2的体积分数为多少?
(3)若温度仍为850℃,初始时CO浓度为2mol/L,H2O(g)为6mol/L,则平衡时CO转化率为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治禽流感病毐目前人类面临的-个重大课题。八角茴香属于草本植物,是我国民间常用做烹调的香料。医学研究成果显示,从八角茴香中可提取到莽草酸. 莽草酸有抗炎, 镇痛作用,也是合成对禽流感病爯毒有一定抑制作用的—种药物“达菲”的前体。莽草酸的结构式如下图所示,下列关于莽草酸的说法正确的是

A. 莽草酸的分子式为C7H4O5
B. 莽草酸的分子之间可能发生酯化反应
C. 莽草酸中含有苯环
D. 莽草酸不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组比较不正确的是( )
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na,故K可以从NaCl溶液中置换出金属钠
C.金属性:K>Na>Li
D.碱金属元素原子最外层电子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃A能使溴的四氣化碳溶液褪色,其密度为相同条件下H2密度的14倍,完全燃烧产生等物质的里的CO2和H2O, A有如下转化关系,回答下列问题:
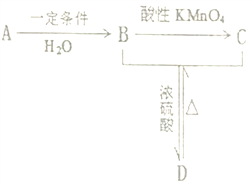
(1)A 的结构简式_______;B中含有的官能团名称______。
(2)A→B的反应类型为_______; C中含有的化学键类型_______。
(3)写出B+C→D的化学方程式_______;
(4)比A多一个碳的A的同系物与HCl气体反应得到的产物的同分异构体有_________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用硫酸铝酸性溶液制备可溶性的碱式硫酸铝[Ala(SO4)b(OH)c],并用它对烟气进行脱硫处理的过程如图1: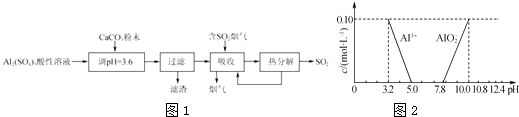
(1)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Ala(SO4)b(OH)c . 过滤时所用的玻璃仪器有、和烧杯,滤渣的主要成分为(填化学式).
(2)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将(填“增大”“减小”或“不变”).
(3)Ala(SO4)b(OH)c中a、b、c的代数关系式为 .
(4)已知在常温下溶液中Al3+、AlO2﹣的浓度与溶液pH的关系如图2所示.为确定碱式硫酸铝的组成,进行如下实验:
①取2.18g碱式硫酸铝样品在空气中灼烧至恒重,样品质量减少了0.36g.
②另取2.18g碱式硫酸铝溶于水,调节溶液的pH到5.0~7.8.
③将②产生的沉淀过滤、洗涤、灼烧至恒重,称量剩余固体为1.02g.
请计算样品中Al3+和SO42﹣的物质的量之比(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是治疗疟疾的有效药物。用水提取青蒿索需采用较高温度,产品药效较差,改用低温、乙醚冷浸,药效显著提高。若把青蒿素制成双氢青蒿素,其治疗疟疾的效果比青蒿素更好。下列叙述中正确的是
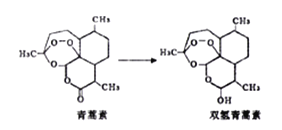
A. 青蒿素的分子式为C15H21O5 B. 双氢青蒿素的水溶性小于青蒿素
C. 青蒿素生成双氢青蒿素属于氧化反应 D. 低温可以减少药物提取过程中过氧键的断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期第ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)工业上用砷废渣制H3AsO4的反应为:2As2S3+5O2+6H2O=4H3AsO4+6S,通常将含砷废渣(主要成分为As2S3)制成浆状,加压通O2氧化。分别分析“制成浆状”、“ 加压通O2”对该反应的影响___________________。
(2)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s) △H1
H2(g)+2O2(g)=H3AsO4(s) △H1
2As(s)+O2(g)=As2O5(s) △H2
H2(g)+ ![]() O2(g)=H2O(l) △H3
O2(g)=H2O(l) △H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s) 的△H=______________。
(3)H3AsO3 和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的依度占各物种浓度之和的分数)与pH的关系分别如图1和图2所示。

①以酚酞为指示剂(变色范围pH:8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为红色时停止滴加。该过程中主要反应的离子方程式为_______________。
②已知H3AsO4的各级电离常数为Ka1、Ka2、Ka3,则Ka2=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com