
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
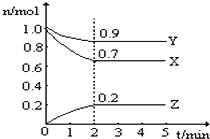
(1)该反应的化学方程式为_______________________
(2)从开始至2min,Z的平均反应速率为___________
(3)其他条件不变,升高温度,逆反应速率将________(填“加快”、“减慢”或“不变”)。
(4)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/S |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究 ______ 、 ______ 对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明 ______ ,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ ;
【答案】3X(g)+Y(g)2Z(g) 0.05mol/(L·min) 加快 接触面积 温度 其他条件相同时,温度越高 II III
【解析】
由图可知,Y、X的物质的量减小,Z的物质的量增加,则Y、X为反应物,Z为生成物,Y、X、Z的△n之比为(1-0.9):(1-0.7):(0.2-0)=1:3:2,2min达到平衡状态,由反应速率之比等于化学计量数之比可知,反应为3X(g)+Y(g)2Z(g),结合v=![]() /
/![]() ;转化率=变化量/开始量
;转化率=变化量/开始量![]() 及反应速率影响因素来解答。
及反应速率影响因素来解答。
(1)由图可Y、X的物质的量减小,Z的物质的量增加,则Y、X为反应物,Z为生成物,Y、X、Z的△n之比为(10.9):(10.7):(0.20)=1:3:2,2min达到平衡状态,由反应速率之比等于化学计量数之比可知,反应为3X(g)+Y(g)2Z(g);答案:3X(g)+Y(g)2Z(g)。
(2)从开始至2min,Z的平均反应速率为0.2mol/(2L![]() 2min)=0.05molL1min1,故答案为:0.05mol/(L·min);
2min)=0.05molL1min1,故答案为:0.05mol/(L·min);
(3)根据影响化学反应速率的因素可知:其他条件不变,升高温度,正、逆反应速率都加快;答案:加快。
(4)①由表格中的数据可以知道,锌的状态不同、温度不同,则实验目的为探究接触面积、温度对锌和稀盐酸反应速率的影响,本题正确答案是:接触面积;温度;
②实验Ⅰ和Ⅱ中,温度不同, 其他条件相同,温度大的反应速率快,即温度越高,反应速率越快;本题正确答案是: 其他条件相同时,温度越高;
③能表明固体的表面积对反应速率有影响,应控制温度相同,则应为II和III组实验;本题正确答案是: II;III。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】
以苯和乙炔为原料合成化工原料E的路线如下:
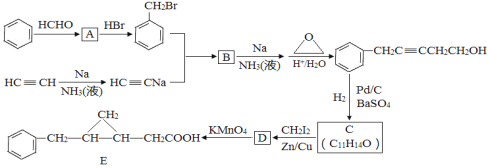
回答下列问题:
(1)A的名称___________________。
(2)生成B的化学方程式为____________________________,反应类型是________。
(3)C的结构简式为____________,C的分子中一定共面的碳原子最多有_____个。
(4)与D同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有______种,请任写两种同分异构体的结构简式:_____________________________。
(5)参照上述合成路线,设计一条以乙炔和必要试剂合成环丙烷的路线:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①⑤五种元素在周期表中的位置:

请按要求回答下列问题:
(1)元素④的原子结构示意图为______.
(2)元素①单质的电子式为______.
(3)元素②⑤的原子半径由大到小的顺序为(填元素符号)______,它们的最高价氧化物对应的水化物中,酸性最强的是______(填化学式).
(4)元素②的单质在氧气中燃烧的产物与二氧化碳反应的化学方程式为______;元素③的最高价氧化物与烧碱溶液反应的离子方程式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4 ═ FeSO4+H2↑的能量变化趋势,如图所示:
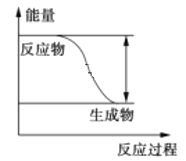
(1)该反应为______反应(填“吸热”或“放热”)
(2)若要使该反应的反应速率加快,下列措施可行的是______(选填A、B、C)。
A.改铁片为铁粉 B.改稀硫酸为98%的硫酸溶液 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为______极(填“正”或“负”),铜片上产生的现象为______,该极上发生的电极反应为______,消耗5.6g Fe时转移的电子数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的碳酸钠溶液;②加入稍过量的氢氧化钠溶液;③加入稍过量的氯化钡溶液;④滴入稀盐酸至无气泡产生;⑤过滤;正确的操作顺序是
A.③②⑤①④B.①②③⑤④C.②③①⑤④D.③⑤②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D. 金属Cu中Cu原子堆积模型如图4,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氡(NH2OH)为一元弱碱(25℃时,电离常数Kb=9.0×l0-9),其电离方程式为:NH2OH+H2O![]() NH3OH++OH-。用0.lmol/L盐酸滴定20mL0.lmol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法不正确的是( )
NH3OH++OH-。用0.lmol/L盐酸滴定20mL0.lmol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法不正确的是( )
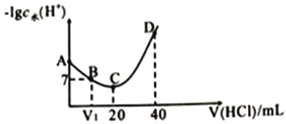
A. A、B、C、D四点对应的溶液中NH2OH电离常数相等
B. A点对应溶液的pH=9.5
C. D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
D. C点时,溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质的有关叙述中正确的是( )
A. 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
B. 乙酸与乙醇可以发生酯化反应,又均可与金属钠发生置换反应
C. 分馏、干馏都是物理变化,裂化、裂解都是化学变化
D. 纤维素![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com