
【题目】某食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的碳酸钠溶液;②加入稍过量的氢氧化钠溶液;③加入稍过量的氯化钡溶液;④滴入稀盐酸至无气泡产生;⑤过滤;正确的操作顺序是
A.③②⑤①④B.①②③⑤④C.②③①⑤④D.③⑤②①④
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜(As2O3)中毒,涉及的反应如下:
Ⅰ: 6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷) ↑+3H2O
Ⅱ: 2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布式__________
(2)砷烷的空间结构为_________;砷烷中心原子杂化方式为________
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3![]() AsH3
AsH3![]() SbH3,熔沸点依次升高的原因是______________________,NH3分子例外的原因是__________________________________.
SbH3,熔沸点依次升高的原因是______________________,NH3分子例外的原因是__________________________________.
(4)第一电离能数据I(As)____ I(Se)
(5)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图所示。
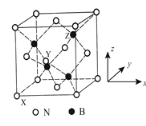
晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(1/2,0,1/2),则Z原子的坐标参数为________。晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d gcm-3,阿伏加德罗常数值为NA,则晶胞参数a=________nm。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
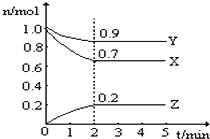
(1)该反应的化学方程式为_______________________
(2)从开始至2min,Z的平均反应速率为___________
(3)其他条件不变,升高温度,逆反应速率将________(填“加快”、“减慢”或“不变”)。
(4)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/S |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究 ______ 、 ______ 对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明 ______ ,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.短周期元素X、Y、Z、R在周期表中的相对位置如图所示,请回答以下问题:

(1)X的原子结构示意图为________,其在周期表中的位置为_______________。
(2)Y与Z的原子半径大小关系是:Y____Z (填“>”或“<”)。
(3)X与R的非金属性强弱顺序是:X____R (填“>”或“<”)。
(4)位于Y下一周期的同主族元素的最高价氧化物对应的水化物的化学式为______。
II.研究表明,在高压与加热的条件下,钠、氦、氧三种元素能形成一种结构特殊的固态化合物Na2HeO。
(1)化合物Na2HeO中氦元素的化合价为0,其中氧元素的化合价为______。
(2)钠、氦气、氧气反应生成Na2HeO的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容器体积可变的密闭容器中,反应N2(g)![]() 3H2(g)
3H2(g) ![]() 2NH3(g)在一定条件下达到平衡。
2NH3(g)在一定条件下达到平衡。
完成下列填空:
(1)若该反应经过2秒钟后达到平衡,NH3的浓度增加了0.4mol/L,在此期间,正反应速率![]() (H2)的值为(_______)
(H2)的值为(_______)
A 0.6mol/(L·s) B 0.45 mol/(L·s) C 0.3 mol/(L·s) D 0.2 mol/(L·s)
(2)在其他条件不变的情况下,增大容器体积以减小反应体系的压强,![]() ____(选填“增大”、“减小”,下同),
____(选填“增大”、“减小”,下同),![]() ____,平衡向____方向移动(选填“正反应”、“逆反应”)。
____,平衡向____方向移动(选填“正反应”、“逆反应”)。

(3)在其他条件不变的情况下,升高温度平衡向逆反应方向移动,则正反应为____反应(选填“吸热”、“放热”)。
(4)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是___(填写编号)。
a.增大H2的浓度 b.缩小容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量____(选填“增大”、“减小”、“不变”)。在一定条件下,反应2A+B![]() C达到平衡。
C达到平衡。
(5)若升高温度,平衡向正反应方向移动,则逆反应是_________热反应;
(6)若增加或减少B时,平衡不移动,则B是_________态;
(7)若A、B、C均为气态,将6mol A、3mol B充入容积为0.5L的密闭容器中,进行反应。经5s后,测得容器内有1mol B,则用A表示的反应速率为_________________________, 5s末时C的物质的量浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应使用催化剂后,其反应过程中能量变化如图所示。下列说法错误的是( )
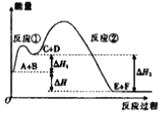
A. 该反应的总反应为放热反应
B. 使用催化剂,不可以改变反应进行的方向
C. 反应①是吸热反应,反应②是放热反应
D. △H2═△H1+△H
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com