
����Ŀ������������ɱ���ܱ������У���ӦN2(g)![]() 3H2(g)
3H2(g) ![]() 2NH3(g)��һ�������´ﵽƽ�⡣
2NH3(g)��һ�������´ﵽƽ�⡣
���������գ�
��1�����÷�Ӧ����2���Ӻ�ﵽƽ�⣬NH3��Ũ��������0.4mol/L���ڴ��ڼ䣬����Ӧ����![]() (H2)��ֵΪ��_______��
(H2)��ֵΪ��_______��
A 0.6mol/(L��s) B 0.45 mol/(L��s) C 0.3 mol/(L��s) D 0.2 mol/(L��s)
��2���������������������£�������������Լ�С��Ӧ��ϵ��ѹǿ��![]() ____��ѡ���������С������ͬ����
____��ѡ���������С������ͬ����![]() ____��ƽ����____�����ƶ���ѡ�����Ӧ�������淴Ӧ������
____��ƽ����____�����ƶ���ѡ�����Ӧ�������淴Ӧ������

��3���������������������£������¶�ƽ�����淴Ӧ�����ƶ���������ӦΪ____��Ӧ��ѡ����ȡ��������ȡ�����
��4����ͼΪ��Ӧ���ʣ�������ʱ�䣨t����ϵ��ʾ��ͼ����ͼ�жϣ���t1ʱ�����߷����仯��ԭ����___����д��ţ���
a.����H2��Ũ�� b.��С������� c.������� d.�����¶�
�ı�������ƽ��������NH3�İٷֺ���____��ѡ���������С���������䡱������һ�������£���Ӧ2A+B![]() C�ﵽƽ�⡣
C�ﵽƽ�⡣
��5���������¶ȣ�ƽ��������Ӧ�����ƶ������淴Ӧ��_________�ȷ�Ӧ��
��6�������ӻ����Bʱ��ƽ�ⲻ�ƶ�����B��_________̬��
��7����A��B��C��Ϊ��̬����6mol A��3mol B�����ݻ�Ϊ0.5L���ܱ������У����з�Ӧ����5s�����������1mol B������A��ʾ�ķ�Ӧ����Ϊ_________________________�� 5sĩʱC�����ʵ���Ũ��Ϊ__________________��
���𰸡�C ��С ��С �淴Ӧ ���� c ���� �� �̣���Һ�� 1.6mol/(L��s) 4 mol/L
��������
(1)2���Ӻ�ﵽƽ�⣬NH3��Ũ��������0.4mol/L��v(NH3)=![]() =0.2mol/(Ls)����Ϸ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȼ���v(H2)��
=0.2mol/(Ls)����Ϸ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȼ���v(H2)��
(2)��С��Ӧ��ϵ��ѹǿ�����淴Ӧ���ʾ���С�����÷�ӦΪ���������С�ķ�Ӧ����ƽ�������ƶ���
(3)�����¶�ƽ�������ȷ�Ӧ�����ƶ���
(4)t1ʱ�̣����淴Ӧ����ͬ�ȳ̶ȵ��������Ի�ѧƽ����Ӱ�죻
(5)����ƽ�������ȵķ����ƶ���
(6)���ӻ����Bʱ��ƽ�ⲻ�ƶ���˵��B��Ũ��û�б仯��B�������壻
(7)��Ӧ����=![]() ��
��
(1)2���Ӻ�ﵽƽ�⣬NH3��Ũ��������0.4mol/L��v(NH3)=![]() =0.2mol/(Ls)���ɷ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȿ�֪v(H2)=0.2mol/(Ls)��
=0.2mol/(Ls)���ɷ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȿ�֪v(H2)=0.2mol/(Ls)��![]() =0.3mol/(Ls)���ʴ�ΪC��
=0.3mol/(Ls)���ʴ�ΪC��
(2)��С��Ӧ��ϵ��ѹǿ�����淴Ӧ���ʾ���С�����÷�ӦΪ���������С�ķ�Ӧ����Сѹǿ�������������ķ����ƶ�����ƽ�����淴Ӧ�����ƶ���
(3)�����¶�ƽ�����淴Ӧ�����ƶ����淴ӦΪ���ȷ�Ӧ��������ӦΪ���ȷ�Ӧ��
(4)t1ʱ�̣����淴Ӧ����ͬ�ȳ̶ȵ�������ƽ�ⲻ�ƶ�����ı������Ϊ�������ʴ�Ϊc�������Ի�ѧƽ����Ӱ�죬��ƽ��������NH3�İٷֺ������䣻
(5)����ƽ�������ƶ���˵������Ӧ�����ȷ�Ӧ�����淴Ӧ�Ƿ��ȷ�Ӧ��
(6)���ӻ����Bʱ��ƽ�ⲻ�ƶ���˵��B��Ũ��û�б仯��B���������ǹ����Һ̬��
(7)��A��B��C��Ϊ��̬����6mol A��3mol B�����ݻ�Ϊ0.5L���ܱ������У����з�Ӧ����5s�����������1mol B����c(B)=![]() =4mol/L������2A+B
=4mol/L������2A+B![]() C��֪����c(A)=��c(B)��
C��֪����c(A)=��c(B)��![]() =8mol/L����A��ʾ�ķ�Ӧ����Ϊ
=8mol/L����A��ʾ�ķ�Ӧ����Ϊ![]() =1.6 mol/(L��s)��5sĩʱC�����ʵ���Ũ��=��c(B)=4mol/L��
=1.6 mol/(L��s)��5sĩʱC�����ʵ���Ũ��=��c(B)=4mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��P4(g)��6Cl2(g)===4PCl3(g) ��H��a kJ��mol��1��
P4(g)��10Cl2(g)===4PCl5(g) ��H��b kJ��mol��1��
��֪�γɻ��1 mol��ѧ���ų������յ�������Ϊ�û�ѧ���ļ��ܡ�P4������������ṹ��PCl5��P��Cl���ļ���Ϊc kJ��mol��1��PCl3��P��Cl���ļ���Ϊ1.2c kJ��mol��1������������ȷ����
A. P��P���ļ��ܴ���P��Cl���ļ���
B. ����Cl2(g)��PCl3(g)===PCl5(s)�ķ�Ӧ����H
C. Cl��Cl���ļ���Ϊ(b��a��5.6c)/4 kJ��mol��1
D. P��P���ļ���Ϊ(5a��3b��12c)/8 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʳ��ˮ�Ժ��п����Ե�CaCl2��MgCl2��Na2SO4�����ʣ�ͨ�����¼���ʵ�鲽�裬���Ƶô�����ʳ��ˮ���ټ����Թ�����̼������Һ���ڼ����Թ���������������Һ���ۼ����Թ������Ȼ�����Һ���ܵ���ϡ�����������ݲ������ݹ��ˣ���ȷ�IJ���˳����
A.�ۢڢݢ٢�B.�٢ڢۢݢ�C.�ڢۢ٢ݢ�D.�ۢݢڢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������ĵ���ƽ�ⳣ�����±���ʾ:
���� | ���� | ������ | ̼�� | ������ |
����ƽ�ⳣ��Ka(25��) | 1.75��10-5 | 2.98��10-8 | Ka1=4.3��10-7 Ka2=5.61��10-11 | Ka1=1.54��10-7 Ka2=1.02��10-7 |
�������ӷ���ʽ��ȷ����
A. ������CO2ͨ��NaClO��Һ��:CO2+H2O+2C1O-==CO32-+2HClO
B. ������SO2ͨ��Na2CO3��Һ��:SO2+H2O+2CO32-==SO32-+2HCO3-
C. ������SO2ͨ��Ca(ClO)2��Һ��:SO2+H2O+Ca2++2ClO-==CaSO3��+2HClO
D. ��ͬŨ�ȵ�NaHCO3��Һ��NaHSO3��Һ��������:H++HCO3-==CO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���1L�����ܱ������м���lmol��N2(g)��3molH2(g)������Ӧ��N2(g)+3H2(g) ![]() 2NH3(g) ��H<0�� NH3�����ʵ�����ʱ��Ĺ�ϵ���±���ʾ������˵������ȷ����( )
2NH3(g) ��H<0�� NH3�����ʵ�����ʱ��Ĺ�ϵ���±���ʾ������˵������ȷ����( )
ʱ��(min) | 0 | t1 | t2 | t3 |
NH3���ʵ���(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min��v(NH3)=0.2/t1mol��L-1��min-1
B. t3ʱ�ټ���1mol��N2(g)��3molH2(g)����Ӧ����ƽ��ʱ��c(N2)>0.85mol��L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)�Ļ��С��2NH3(g)
2NH3(g)�Ļ��С��2NH3(g) ![]() N2(g)+3H2(g)�Ļ��
N2(g)+3H2(g)�Ļ��
D. �����¶ȣ���ʹ����Ӧ���ʼ�С���淴Ӧ��������ƽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����(NH2OH)ΪһԪ����(25��ʱ�����볣��Kb=9.0��l0-9)������뷽��ʽΪ��NH2OH+H2O![]() NH3OH++OH-����0.lmol/L����ζ�20mL0.lmol/L NH2OH��Һ���㶨25��ʱ���ζ���������ˮ���������H+Ũ�ȵĸ���������������Ĺ�ϵ��ͼ��ʾ(��֪��lg3=0.5)������˵������ȷ����( )
NH3OH++OH-����0.lmol/L����ζ�20mL0.lmol/L NH2OH��Һ���㶨25��ʱ���ζ���������ˮ���������H+Ũ�ȵĸ���������������Ĺ�ϵ��ͼ��ʾ(��֪��lg3=0.5)������˵������ȷ����( )
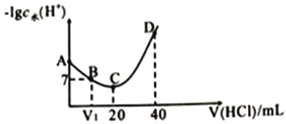
A. A��B��C��D�ĵ��Ӧ����Һ��NH2OH���볣�����
B. A���Ӧ��Һ��pH=9.5
C. D���Ӧ��Һ�д��ڣ�c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
D. C��ʱ����Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪ![]() ������˵����ȷ����
������˵����ȷ����
A. 1L0.1mol��![]() NH4Cl��Һ�У�
NH4Cl��Һ�У� ![]() ������Ϊ0.1
������Ϊ0.1![]()
B. 2.4gMg��H2SO4��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.1![]()
C. ��״���£�2.24LN2��O2�Ļ�������з�����Ϊ0.2![]()
D. 0.1mol H2��0.1mol I2���ܱ������г�ַ�Ӧ�����������Ϊ0.2![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������Ӻ�ˮ��Դ��ȡijЩ��Ҫ����ԭ�ϵ�����ʾ��ͼ��
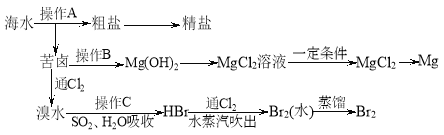
�ش��������⣺
��1������A��___________��������ʵ�����������������
��2������B����������Լ��е�һ�֣�����ʵ���______��ѡ��������
a������������Һ
b������ʯ��ˮ
c��ʯ����
d��̼������Һ
��3�����±��ͨ��Cl2��������Ӧ�����ӷ���ʽ��________________________________��
��SO2ˮ��Һ����Br2�������ʿɴ�95%���йط�Ӧ�����ӷ���ʽΪ_______________��
��4����ҵ������ˮMgCl2��ȡþ�Ļ�ѧ����ʽΪ__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ͷ����������γ�����ʱ������еİ��йأ���ͼ�������������������

A. �������ķ�ɢ����ͬ B. �����к�������狀������
C. NH3���γ���������Ĵ��� D. �������γ������ʩ�õ��ʡ�ȼ��ȼ�� �й�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com