
【题目】下列有关说法不正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D. 金属Cu中Cu原子堆积模型如图4,为最密堆积,每个Cu原子的配位数均为12
【答案】C
【解析】
水合铜离子中铜离子的配位数为4,配体是水,水中的氧原子提供孤电子对与铜离子形成配位键;根据均摊法可知,在CaF2晶体的晶胞中,每个CaF2晶胞平均占有Ca2+个数为8×1/8+6×1/2=4;电子云密度表示电子在某一区域出现的机会的多少,H原子最外层只有一个电子,所以不存在大多数电子一说,只能说H原子的一个电子在原子核附近出现的机会较多;在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个原子周围都有12个原子与之相连,对于铜原子也是如此。
水合铜离子中铜离子的配位数为4,配体是水,水中的氧原子提供孤电子对与铜离子形成配位键,A正确;根据均摊法可知,在CaF2晶体的晶胞中,每个CaF2晶胞平均占有Ca2+个数为8×1/8+6×1/2=4,B正确;电子云密度表示电子在某一区域出现的机会的多少,H原子最外层只有一个电子,所以不存在大多数电子一说,只能说H原子的一个电子在原子核附近出现的机会较多,C错误;在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个原子周围都有12个原子与之相连,对于铜原子也是如此,故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是

![]()
A. a是负极,电池工作时,电子的流动力向是:电极a-负载一电极b-质子膜一电极a
B. 电池工作时,化学能转化为电能和热能
C. 电极b上发生的电极反应式为O2+ 4e-+4H+=2H2O
D. 当电路中通过4mol电子时,有4molH+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
A. 单位时间内生成n mol O2 的同时,生成2n molNO2 B. 混合气体的平均相对分子质量不再改变
C. 混合气体的颜色不再改变 D. NO2, NO, O2的速率之比是2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒等多种元素构成薄膜太阳能电池。回答下列问题:
(1)基态亚铜离子(Cu+)的价层电子排布式为__________。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能(947kJ·mo1-1)大于硒(941k]·mol-l)。请从原子结构的角度加以解释__________。
(3)H2O的沸点高于H2Se的沸点,其原因是__________。
(4)GaCl3和AsF3的分子立体构型分别是__________,__________。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4] -中B原子的杂化类型为__________。
②[B(OH)4] -的结构式为__________。
(6)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是__________(用化学式表示)
②金刚石的晶胞参数为apm(lpm=10-12m),1cm3晶体的平均质量为__________g(只要求列算式,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
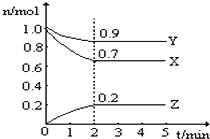
(1)该反应的化学方程式为_______________________
(2)从开始至2min,Z的平均反应速率为___________
(3)其他条件不变,升高温度,逆反应速率将________(填“加快”、“减慢”或“不变”)。
(4)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/S |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究 ______ 、 ______ 对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明 ______ ,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氯化氢的反应化学方程式为:H2SO4(浓)+NaCl=HCl↑+NaHSO4,回答以下问题:
(1)该反应能发生的原因是________________。
A.硫酸酸性强于盐酸 B.盐酸易挥发 C.硫酸氧化性强于盐酸
(2)向NaHSO4溶液中滴加Ba(OH)2溶液至中性,反应的离子方程式为_____________________。
(3)实验室需要配制0.50 mol·L-1 NaCl溶液240 mL。
①所需的仪器有:托盘天平、药匙、烧杯、________、______、______以及等质量的两片滤纸。
②配制该溶液需取NaCl晶体______ g。
③配制一定物质的量浓度溶液定容时的操作是____________________________________
(4)在标准状况下,将44.8 L HCl气体溶于127 mL水中,所得盐酸的密度为1.18 g·cm-3。该盐酸的物质的量浓度是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓盐酸中加入浓硫酸时,会有白雾生成。下列叙述与该现象无关的是( )
A.浓硫酸具有脱水性
B.浓硫酸具有吸水性
C.浓盐酸具有挥发性
D.气态溶质的溶解度随温度的升高而降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法不正确的是( )
A.硅在地壳中的含量仅次于氧
B.硅在自然界中既有化合态,又有游离态
C.硅是人类将太阳能转换为电能的常用材料
D.硅单质的导电能力介于导体和绝缘体之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的说法正确的是
A.铝和氢氧化钠溶液反应生成Al(OH)3和H2O
B.钠在空气中燃烧生成淡黄色的Na2O
C.铁在高温下与水蒸气反应生成Fe2O3和H2
D.碳酸钠溶液和氢氧化钙溶液反应生成NaOH和CaCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com