
【题目】向浓盐酸中加入浓硫酸时,会有白雾生成。下列叙述与该现象无关的是( )
A.浓硫酸具有脱水性
B.浓硫酸具有吸水性
C.浓盐酸具有挥发性
D.气态溶质的溶解度随温度的升高而降低
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co) < I4(Fe),其原因是______________________________;Co 与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是___________________________________________________.
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3)K 和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是___________________________________________________________________ 。
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如图所示,沸点按图像所示变为的原因是_______ 。

(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(1/2,0,1/2),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4 ═ FeSO4+H2↑的能量变化趋势,如图所示:
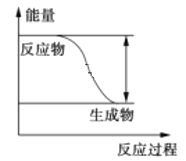
(1)该反应为______反应(填“吸热”或“放热”)
(2)若要使该反应的反应速率加快,下列措施可行的是______(选填A、B、C)。
A.改铁片为铁粉 B.改稀硫酸为98%的硫酸溶液 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为______极(填“正”或“负”),铜片上产生的现象为______,该极上发生的电极反应为______,消耗5.6g Fe时转移的电子数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D. 金属Cu中Cu原子堆积模型如图4,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氡(NH2OH)为一元弱碱(25℃时,电离常数Kb=9.0×l0-9),其电离方程式为:NH2OH+H2O![]() NH3OH++OH-。用0.lmol/L盐酸滴定20mL0.lmol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法不正确的是( )
NH3OH++OH-。用0.lmol/L盐酸滴定20mL0.lmol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法不正确的是( )
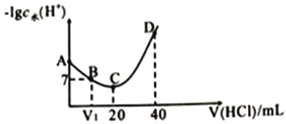
A. A、B、C、D四点对应的溶液中NH2OH电离常数相等
B. A点对应溶液的pH=9.5
C. D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
D. C点时,溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应方程式正确的是( )
A. 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH + CO32-→CO2↑+ H2O + 2C6H5O-
B. 溴乙烷与氢氧化钠水溶液反应:![]()
C. 醋酸除水垢的离子方程式:CaCO3 + 2H+= Ca2+ + CO2↑+H2O
D. 苯甲醇与氧气发生催化氧化:2C6H5CH2OH + O2![]() 2C6H5CHO + 2H2O
2C6H5CHO + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小粒金属钠投入到盛有冷水的小烧杯中,以下描述合理的是
A. 无明显现象 B. 烧杯内溶液颜色逐渐变红
C. 金属钠浮于液面上,四处游动 D. 金属钠沉入烧杯底部,并产生气泡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com