
【题目】能正确表示下列反应的离子方程式的是( )
A.向澄清石灰水中通入少量SO2气体:Ca2++SO2=CaSO3↓
B.过量SO2气体通入氢氧化钠溶液中:SO2+OH-=![]()
C.SO2气体通入溴水中:SO2+Br2+H2O=2H++2Br-+![]()
D.向氢硫酸中通入氯气:S2-+Cl2=S↓+2Cl-
【答案】B
【解析】
A.向澄清石灰水中通入少量SO2气体,反应的化学方程式是SO2(少量)+Ca(OH)2=CaSO3↓+H2O,对应的离子方程式是Ca2++2OH-+SO2=CaSO3↓+H2O,A错误;
B.过量SO2气体通入氢氧化钠溶液中,反应的化学方程式是SO2+NaOH=NaHSO3,对应的离子方程式是SO2+OH-=![]() ,B正确;
,B正确;
C.SO2气体通入溴水中,反应的化学方程式是SO2+Br2+2H2O=2HBr+H2SO4,对应的离子方程式是SO2+Br2+2H2O=4H++2 Br-+![]() ,C错误;
,C错误;
D.氢硫酸是弱酸,向氢硫酸中通入氯气的离子方程式为:H2S+Cl2=S↓+2H++2Cl-,D错误;
答案选B。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】甲、乙两同学为探究![]() 与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
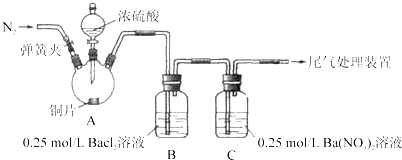
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡,B中有气泡冒出,产生大量白色沉淀,C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是_______,该沉淀的生成表明SO2具有_______性。
(3)C中液面上方生成浅棕色气体的化学方程式是______。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是____;乙在A、B间增加洗气瓶D,D中盛放的试剂是______。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下,11.2L HF含有的分子数目为0.5NA
B. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
C. 常温下,0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子数小于0.2NA
D. 18g葡萄糖(C6H12O6)分子含有的羟基数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸生产中存在炉气转化反应:2SO2(g)+O2(g)![]() 2SO3(g)。研究发现,SO3的体积分数随温度(T)的变化如曲线I所示。下列判断正确的是
2SO3(g)。研究发现,SO3的体积分数随温度(T)的变化如曲线I所示。下列判断正确的是

A.该反应的正反应为吸热反应
B.反应达到B点时,2υ正(O2)=υ逆(SO3)
C.曲线I上A、C两点反应速率的关系:υA>υC
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5作催化剂时的曲线,则II是Fe2O3作催化剂时的曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)下列六种生活中常见物质:
①食盐 ②食用油 ③靑霉素 ④鸡蛋 ⑤西红柿 ⑥塑料
按要求用物质序号填空:
作调味剂的是___________;作抗生素的是___________;富含蛋白质的是___________;富含维生素的是___________;富含油脂的是___________;属于合成材料的是___________。
(2)一个体重50 kg的健康人,体内约含有2 g铁,这2 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+, 有利于人体吸收。
i.在人体中进行Fe2+ ![]() Fe3+的转化时,①中的Fe2+作________ (填“氧化剂”或“还原剂”),②中的Fe3+作________ (填“氧化剂”或“还原剂”)。
Fe3+的转化时,①中的Fe2+作________ (填“氧化剂”或“还原剂”),②中的Fe3+作________ (填“氧化剂”或“还原剂”)。
ii.服用维生索C,可使食物中的Fe3+还原成Fe2+这句话指出,维生素C在这一反应中作 ____________(填“氧化剂”或“还原剂”)
iii.市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸 (HC1)的作用下转化成亚铁盐。此反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,B和酸性气体D反应能生成C,A露置在空气中足够长时间也会变为C,E与D反应也能生成C,A、B都能与水反应生成E。回答下列问题:
(1)写出下列物质的化学式: B________,C________,D________,E________。
(2)写出下列反应的化学方程式:
①A生成B:____________________;
②B与水反应生成E:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(![]() )可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,受热易分解,在酸性溶液中不能稳定存在.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
)可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,受热易分解,在酸性溶液中不能稳定存在.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
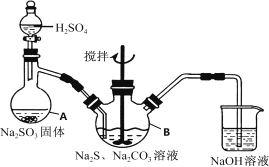
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的![]() 气体较均匀地通入
气体较均匀地通入![]() 和
和![]() 的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的![]() 接近7时,停止通入
接近7时,停止通入![]() 气体。
气体。
③趁热过滤,将滤液加热浓缩,冷却析出![]() 。
。
④再经过滤、洗涤、干燥,得到所需的产品。
(1)仪器A的名称是_________。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液![]() ,请用离子方程式表示原因_________。
,请用离子方程式表示原因_________。
(3)写出三颈烧瓶B中制取![]() 反应的总化学反应方程式_________。
反应的总化学反应方程式_________。
(4)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下列装置进行实验:
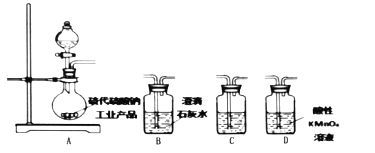
①实验装置的连接顺序依次_________(填装置的字母代号,各装置限用一次),装置C中的试剂为_________。
②能证明固体中含有碳酸钠的实验现象是_________。
③若要检验固体硫代硫酸钠工业产品中含有![]() ,需先加水配成稀溶液,再依次加入的试剂为_________、_________和品红溶液。
,需先加水配成稀溶液,再依次加入的试剂为_________、_________和品红溶液。
(5)![]() 常用作脱氯剂,在溶液中易被
常用作脱氯剂,在溶液中易被![]() 氧化成
氧化成![]() ,该反应的离子方程式为_________。
,该反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
诺氟沙星为喹诺酮类抗生素,其合成路线如下:
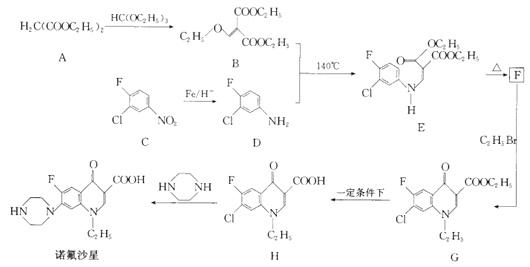
回答下列问题:
(1)化合物A的名称是____________。
(2)诺氟沙星分子中含氧官能团的名称为____________。
(3)C生成D,H生成诺氟沙星的反应类型分别是___________、___________。
(4)F的结构简式为_______________。
(5)G生成H的化学方程式为__________________。
(6)有机物X比B分子少一个CH2原子团,且含有酯基和![]() 结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
(7)参照上述合成路线写出由有机物![]() 、B为有机原料合成
、B为有机原料合成 的路线图______________(无机试剂任选)。
的路线图______________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com