
����Ŀ���ס�����ͬѧΪ̽��![]() ������Ա���ǿ�����ܷ�Ӧ���ɰ�ɫBaSO3����������ͼ��ʾװ�ý���ʵ�飨�г�װ�ú�A�м���װ�����ԣ��������Ѽ��飩��
������Ա���ǿ�����ܷ�Ӧ���ɰ�ɫBaSO3����������ͼ��ʾװ�ý���ʵ�飨�г�װ�ú�A�м���װ�����ԣ��������Ѽ��飩��
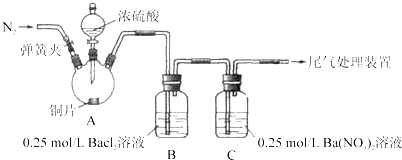
ʵ�����������
���� | ���� |
�رյ��ɼУ��μ�һ����Ũ���ᣬ���� | A���а������ɣ�ͭƬ����������ݣ�B��������ð��������������ɫ������C�в�����ɫ������Һ���Ϸ�����dz��ɫ������ʧ |
���ɼУ�ͨ��N2��ֹͣ���ȣ�һ��ʱ���ر� | |
��B��C�зֱ�ȡ������ɫ��������ϡ���� | ��δ���ְ�ɫ�����ܽ� |
(1)A�з�Ӧ�Ļ�ѧ����ʽ��_________________��
(2)C�а�ɫ������_______���ó��������ɱ���SO2����_______�ԡ�
(3)C��Һ���Ϸ�����dz��ɫ����Ļ�ѧ����ʽ��______��
(4)����B�в�����ϡ����ij���������ԭ����Ϊ�ǿ������뷴Ӧ������Ϊ�ǰ������뷴Ӧ��
��δ֤ʵ���ԵĹ۵㣬��ԭʵ������ϣ�����ԭ�в���֮ǰ����һ���������ò�����____������A��B������ϴ��ƿD��D��ʢ�ŵ��Լ���______��
������ʵ�飬B������
�� | ������ɫ���� |
�� | ������ɫ���� |
�����ɫ���������־�������ϡ���ᡣ������ӷ���ʽ����ʵ��������ͬ��ԭ��___��
(5)�ϲ���4������ͬѧ�ķ����������顣B���������ɣ���C�в�����ɫ�������ɴ˵ó��Ľ�����_____��
���𰸡�2H2SO4(Ũ)��Cu ![]() CuSO4��2H2O��2SO2�� BaSO4 ��ԭ 2NO+O2=2NO2 ͨN2һ��ʱ�䣬�ų�װ�õĿ��� ���͵�NaHSO3��Һ ����SO42����Ba2��=BaSO4��������2Ba2����2SO2��O2��2H2O=2BaSO4��4H������������ҪԶ����װ������������ SO2������Ա���ǿ���β��ܷ�Ӧ����BaSO3����
CuSO4��2H2O��2SO2�� BaSO4 ��ԭ 2NO+O2=2NO2 ͨN2һ��ʱ�䣬�ų�װ�õĿ��� ���͵�NaHSO3��Һ ����SO42����Ba2��=BaSO4��������2Ba2����2SO2��O2��2H2O=2BaSO4��4H������������ҪԶ����װ������������ SO2������Ա���ǿ���β��ܷ�Ӧ����BaSO3����
��������
��1���������֪��A�з���Cu��Ũ����ķ�Ӧ����������ͭ�����������ˮ��
��2��C�а�ɫ����Ϊ���ᱵ��SԪ�صĻ��ϼ����ߣ�
��3��C��Һ���Ϸ�����NO���������ɶ��������ķ�Ӧ��
��4����B�������ᱵ�������е�����������������������B��C�б����ӷ�Ӧ���ڰ�ɫ���������������ᣬ���ɫ����Ϊ���ᱵ���Դ˷��������ķ�Ӧ��
��5��SO2������Ա���ǿ���β��ܷ�Ӧ��SO2������Ա����������ܷ�Ӧ��
��1��A����ͭ��Ũ���ᷴӦ��������ͭ�Ͷ��������ˮ����Ӧ�Ļ�ѧ����ʽΪ��Cu + 2H2SO4(Ũ)![]() CuSO4+SO2��+2H2O���ʴ�Ϊ��Cu + 2H2SO4(Ũ)
CuSO4+SO2��+2H2O���ʴ�Ϊ��Cu + 2H2SO4(Ũ)![]() CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��
��2��������������ˮΪ�����ᣬ�����ᱵ��Ӧ�������ᱵ����������ɫ����ΪBaSO4��˵�����������л�ԭ�ԣ��ʴ�Ϊ��BaSO4��
��3�����������ԭΪһ���������壬������е������Ӵ���Ӧ���ɶ�������������ɫ���壬����ʽΪ��2NO+O2=2NO2���ʴ�Ϊ��2NO+O2=2NO2��
��4����A�а������ܺ���SO3��H2SO4����B�а�ɫ����������ϡ���ᣬ˵���ð�ɫ����ΪBaSO4����ͬѧΪ�ų�װ���ڿ�����ʵ������Ӱ�죬��Cu��Ũ���ᷴӦǰ������ͨһ���N2���ų�װ���еĿ�������ͬѧΪ��ȥ������SO2�е�SO3������A��B������һ��ʢ��Ũ�����NaHSO3��Һ��ϴ��ƿ�������ڼ�ͬѧû���ų������ĸ��ţ�������BaSO4���������ӷ���ʽΪSO42��+Ba2��=BaSO4������ͬѧû���ų������ĸ��ţ�������BaSO4�����ӷ���ʽΪ2Ba2��+2SO2+O2+2H2O=2BaSO4��+4H�����ʴ�Ϊ������SO42����Ba2��=BaSO4��������2Ba2����2SO2��O2��2H2O=2BaSO4��4H������������ҪԶ����װ��������������
��5���ϲ��ס�����ͬѧ�ķ�������ʵ��ʱ��B���������ɣ�C�в�����ɫ������˵��SO2������Ա���ǿ���β��ܷ�Ӧ����BaSO3�������ʴ�Ϊ��SO2������Ա���ǿ���β��ܷ�Ӧ����BaSO3������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����[��Ҫ�ɷ�ΪFe(CrO2)2]������Al2O3��Fe2O3��SiO2������Ϊ��Ҫԭ�������ظ����ƾ���(Na2Cr2O7��2H2O)����Ҫ�����������£����ڸ�����˵���������ǣ� ��

A.��������Na2CrO4�Ļ�ѧ����ʽΪ��4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4 +8CO2
2Fe2O3+8Na2CrO4 +8CO2
B.SiO2�ڡ��������ˡ������к�Fe2O3һ���ȥ
C.Na2CrO4��Na2Cr2O7ת����ԭ��Ϊ��2H��+2CrO42��![]() Cr2O72��+H2O
Cr2O72��+H2O
D.�ù����С����ա�������CO2�����ڡ����ӡ������Խ�Լ�����ɱ���Ϊ��ȫ��ȥAlO2�������������ӷ�ӦΪ��CO2+AlO2��+2H2O=Al(OH)3��+HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧ����ԭ������̼�������ܻ�������ЧӦ���ܵõ���ϩ���ش��������⣺
��1����֪��C2H4(g)+H2O(g)=C2H5OH(g) ��H1=-45.8kJ��mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ��H2=-1277.0kJ��mol-1
��2CO2(g)+2H2O(g)=C2H4(g)+3O2(g)��H3=____��
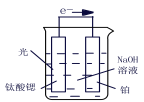
��2���绯ѧ����ԭ������̼Ϊ��ϩԭ����ͼ��ʾ��
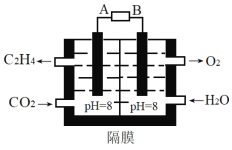
AΪ��Դ��___��(����������������)�������缫��ӦʽΪ___����·��ת��0.2mol���ӣ������ϲ�������___L����״������
��3��ͭ�����������ԭ������ϩ��ѡ���ԣ�ˮ��Һ�ж�����̼��ͭ���滹ԭΪ��ϩ�Ļ�����ͼ��ʾ�����뷴Ӧ��ˮ���Ӽ�����������δ�������������й�˵������ȷ����___�����ţ���
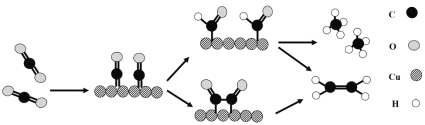
A.ͭ�Ƕ�����̼ת��Ϊ��ϩ�Ĵ���
B.������̼��ԭ�����м������ϩ
C.������Ӧ���̶����ȼ����ٳ���
D.������Ӧ���̶�����̼�����Ķ�����̼̼�����γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ú�̼������ϳ�ȼ���ǽ����ԴΣ������Ҫ��������֪CO(g)��2H2(g)![]() CH3OH(g)��Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���ǣ� ��
CH3OH(g)��Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���ǣ� ��
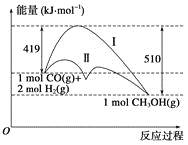
A.�÷�Ӧ����H����91 kJ��mol��1
B.����������÷�Ӧ����H��С
C.��Ӧ��������������������������
D.����÷�Ӧ����Һ̬CH3OH������H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ�Ȼ�ͭ����Ҫ����ɱ������
(1)��ʽ�Ȼ�ͭ�ж����Ʊ�����
�ٷ���1��45 ~ 50��ʱ����CuCl����Һ�г���ͨ������õ�Cu2 (OH)2 Cl2��3H2O���÷�Ӧ�Ļ�ѧ����ʽΪ_____________��
�ڷ���2�����Ƶ�CuCl2������ʯ���鷴Ӧ���ɼ�ʽ�Ȼ�ͭ��Cu��ϡ�����ڳ���ͨ������������·�Ӧ����CuCl2��Fe3+�Ը÷�Ӧ�д�����,���ԭ����ͼ��ʾ��M'�Ļ�ѧʽΪ______��
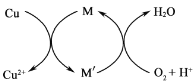
(2)��ʽ�Ȼ�ͭ�ж���������ɱ�ʾΪCua(OH)bClc��xH2O��Ϊ�ⶨij��ʽ�Ȼ�ͭ���������������ʵ����
�ٳ�ȡ��Ʒ2.2320g��������ϡHNO3�ܽ�����100.00mL��ҺA��
��ȡ25. 00mL��ҺA����������AgNO3��Һ����AgCl 0. 3444g��
����ȡ25. 00mL��ҺA������pH 4 ~ 5����Ũ��Ϊ0.08000mol��L-1��EDTA(Na2H2Y��2H2O)����Һ�ζ�Cu2+ (���ӷ���ʽΪCu2++ H2Y2��=CuY2��+2H+)���ζ����յ������ı���Һ60.00mL��ͨ������ȷ������Ʒ�Ļ�ѧʽ(д���������)��_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��������������õ��Ľ�����ȷ����
ѡ�� | ʵ����������� | ���� |
A | �����£�������Һ��ͨ������CO2����Һ����ǡ� | ̼������Աȱ��ӵ�ǿ |
B | �����£���Ũ�Ⱦ�Ϊ0.1 mol��L�C1��BaCl2��CaCl2�����Һ�еμ�Na2SO4��Һ�����ְ�ɫ������ | Ksp��BaSO4����Ksp��CaSO4�� |
C | �����£���FeCl3��Һ�еμ�����KI��Һ���ٵμӼ��ε�����Һ����Һ����ɫ�� | Fe3+�������Ա�I2��ǿ |
D | �����£���pH��ֽ��ã�0.1mol��L�C1Na2SO3��Һ��pHԼΪ10��0.1mol��L�C1NaHSO3��Һ��pHԼΪ5�� | HSO3�C���H���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У���ȷ����
A.�ö��Ե缫���MgCl2��Һ��2Cl-+H2O![]() 2OH-+Cl2��+H2��
2OH-+Cl2��+H2��
B.̼������Һ�Լ��ԣ�CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
C.����ͨ����ˮ�У�Cl2 ��H2O ![]() Cl����ClO����2H+
Cl����ClO����2H+
D.̼��þ����Һ�мӴ��CO32����2CH3COOH�� 2CH3COO����CO2����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�������Դ����������ȡ�봢��������Դ����������о��ȵ㡣
(1)�ȷֽⷨ���⡣ij�¶ȣ�H2O(g) ![]() H2(g)+1/2O2(g)���÷�Ӧƽ�ⳣ������ʽK=_____
H2(g)+1/2O2(g)���÷�Ӧƽ�ⳣ������ʽK=_____
(2)�Ȼ�ѧѭ�����⡣�Ʊ�H2�ķ�Ӧ�������£�
��Br2(g) + CaO(s) = CaBr2(s) + 1/2O2(g) ��H=��73 kJ��mol-1
��3FeBr2(s) + 4H2O(g) = Fe3O4(s) + 6HBr(g) + H2(g) ��H=+384 kJ��mol-1
��CaBr2(s) + H2O (g) = CaO(s) + 2HBr(g) ��H=+212 kJ��mol-1
��Fe3O4(s)+8 HBr(g) = Br2(g) + 3FeBr2(s) + 4H2O(g) ��H=��274 kJ��mol-1
�� H2O(g) ![]() H2(g)+1/2O2(g) ��H =_________kJ��mol��1��
H2(g)+1/2O2(g) ��H =_________kJ��mol��1��
(3)��绯ѧ�ֽ����⣬�����ȹ�缫:4OH-��4e- ![]() O2+2H2O���缫�ĵ缫��ӦΪ_______��
O2+2H2O���缫�ĵ缫��ӦΪ_______��
(4)ˮú�������⡣CO(g) + H2O(g) ![]() CO2(g)+ H2(g) ��H <0����850��ʱ��K=1��
CO2(g)+ H2(g) ��H <0����850��ʱ��K=1��
�� �������¶ȵ�950��ʱ���ﵽƽ��ʱK_________1(������������������ ������)��
�� 850��ʱ������һ�ݻ��ɱ���ܱ�������ͬʱ����1.0 mol CO��3.0 mol H2O��1.0 mol CO2 ��x mol H2����Ҫʹ������Ӧ��ʼʱ������Ӧ������У���xӦ�����������_________��
(5)�������⡣��1.0 mol CH4��2.0 mol H2O (g)ͨ���ݻ�Ϊ100 L�ķ�Ӧ�ң���һ�������·�����Ӧ��CH4(g) + H2O (g)��CO (g) + 3H2(g)����ôﵽƽ�������ʱ��Ϊ5 min��CH4��ƽ��ת����Ϊ50%������H2��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ_____��
(6)LiBH4���зdz��ߵĴ����������ֽ�ʱ�����⻯﮺����ַǽ������ʡ��÷�Ӧ�Ļ�ѧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ����(����)
A.�����ʯ��ˮ��ͨ������SO2���壺Ca2����SO2=CaSO3��
B.����SO2����ͨ������������Һ�У�SO2��OH��=![]()
C.SO2����ͨ����ˮ�У�SO2��Br2��H2O=2H����2Br����![]()
D.����������ͨ��������S2����Cl2=S����2Cl��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com