
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1:45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O,该反应的化学方程式为_____________。
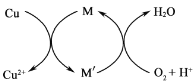
②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:
①称取样品2.2320g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25. 00mL溶液A,加入足量AgNO3溶液,得AgCl 0. 3444g;
③另取25. 00mL溶液A,调节pH 4 ~ 5,用浓度为0.08000mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液60.00mL。通过计算确定该样品的化学式(写出计算过程)。_____________
【答案】4CuCl + O2+ 8H2O=2Cu2(OH)2Cl2·3H2O Fe2+ Cu2 (OH)3Cl·H2O
【解析】
(1)①方法1: 45 ~ 50℃时,CuCl与水、空气中氧气反应生成Cu2(OH)2Cl2·3H2O;②铜化合价升高,则M化合价降低,应为Fe3+变为Fe2+。
(2)先计算n(Cl-),再计算n(Cu2+),得出n(Cu2+) 、n(Cl-)比例关系,再根据物质化合价代数和为0,再求出摩尔质量,最终得到样品的化学式。
(1)①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,CuCl与水、空气中氧气反应生成Cu2(OH)2Cl2·3H2O,其反应的化学方程式为4CuCl + O2+ 8H2O = 2Cu2(OH)2Cl2·3H2O;故答案为:4CuCl + O2+ 8H2O = 2Cu2(OH)2Cl2·3H2O;
②铜化合价升高,则M化合价降低,应为Fe3+变为Fe2+,M'的化学式为Fe2+;故答案为:Fe2+;
(2)①称取样品2.2320 g,用少量稀HNO3溶解后配成100.00 mL溶液A,消耗氢氧根;②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 3444 g,则n(Cl-)= n(AgCl),其物质的量![]() ;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液60.00 mL,则n(Cu2+)= 0.08000 mol·L-1×0.06L = 0.0048mol,n(Cu2+):n(Cl-) = 0.0048mol:0.0024mol = 2:1,Cu2(OH)bCl·xH2O,即根据化合价代数和为0得出Cu2(OH)3Cl·xH2O,其摩尔质量
;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液60.00 mL,则n(Cu2+)= 0.08000 mol·L-1×0.06L = 0.0048mol,n(Cu2+):n(Cl-) = 0.0048mol:0.0024mol = 2:1,Cu2(OH)bCl·xH2O,即根据化合价代数和为0得出Cu2(OH)3Cl·xH2O,其摩尔质量![]() ,64×2 + 17×3 + 35.5 + 18x = 232.5,解得x = 1,因此该样品的化学式Cu2 (OH)3Cl·H2O,故答案为:Cu2 (OH)3Cl·H2O。
,64×2 + 17×3 + 35.5 + 18x = 232.5,解得x = 1,因此该样品的化学式Cu2 (OH)3Cl·H2O,故答案为:Cu2 (OH)3Cl·H2O。


科目:高中化学 来源: 题型:
【题目】某温度下,向如图所示装置中分别通入等质量的![]() 四种气体(已知:密封隔板Ⅰ、Ⅱ、Ⅲ、Ⅳ可自由滑动,且与容器内壁摩擦不计),下列说法中正确的是( )
四种气体(已知:密封隔板Ⅰ、Ⅱ、Ⅲ、Ⅳ可自由滑动,且与容器内壁摩擦不计),下列说法中正确的是( )
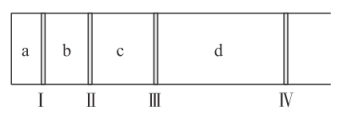
A.![]() 中装的是
中装的是![]() B.
B.![]() 和
和![]() 中气体物质的量之比为
中气体物质的量之比为![]()
C.![]() 和
和![]() 中气体分子数相等D.
中气体分子数相等D.![]() 和
和![]() 中气体密度之比为
中气体密度之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应限度的叙述正确的是
A. 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
B. 依据焓判据:NH4HCO3受热分解可自发进行
C. 大多数化学反应在一定条件下都有一定的限度
D. FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解等,依据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6mol·L-1,该温度下,pH=10的NaOH溶液的物质的量浓度为___。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl②NH3·H2O③H2SO4④(NH4)2SO4,其中水的电离程度由大到小顺序为___(填标号)。
(3)25℃时,将amol·L-1的醋酸和bmol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则a___b(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧沉淀,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子B.Cl- 一定存在,且c(Cl-)≥0.4mol/L
C.SO42- 、NH4+一定存在,Cl- 可能不存在D.K+、CO32-一定不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学为探究![]() 与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
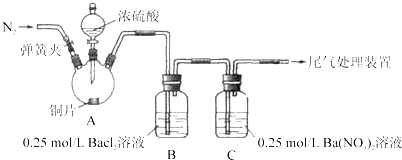
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡,B中有气泡冒出,产生大量白色沉淀,C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是_______,该沉淀的生成表明SO2具有_______性。
(3)C中液面上方生成浅棕色气体的化学方程式是______。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是____;乙在A、B间增加洗气瓶D,D中盛放的试剂是______。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】槟榔碱(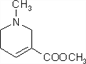 )为油状液体,有拟胆碱作用,在医疗上用于治疗青光眼。某学生设计了以X为原料的合成路线如下:
)为油状液体,有拟胆碱作用,在医疗上用于治疗青光眼。某学生设计了以X为原料的合成路线如下:
X(C5H8O2) ![]() A(C5H11O2N)
A(C5H11O2N)![]() B(C10H19O4N)
B(C10H19O4N)![]() C(C8H13O3N)
C(C8H13O3N)![]() D(C8H15O3N)
D(C8H15O3N)![]() E(
E(![]() )
)![]() F(C7H11O2N)
F(C7H11O2N)![]() G(槟榔碱)
G(槟榔碱)
已知:① X能使溴水褪色、能水解,水解产物之一为乙醇。
②CH3COOC2H5 ![]() CH3COCH2COOC2H5
CH3COCH2COOC2H5
③CH3COOH ![]() CH2BrCOOH
CH2BrCOOH
(1)C的结构简式:_________________________
(2)下列说法不正确的是:______________
A.化合物A有氨基和酯基两种官能团
B.化合物D有碱性
C.由结构推断化合物E可能溶于水
D.化合物F可以使溴水和KMnO4溶液褪色,原理相同
(3)D→E 反应的方程式:_________________________________
(4)烟酸(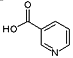 )也可以合成槟榔碱。写出符合下列条件的烟酸可能的同分异构体的结构简式____________。
)也可以合成槟榔碱。写出符合下列条件的烟酸可能的同分异构体的结构简式____________。
①含且只含有一个六元环,环上无氧原子 ②1H-NMR谱表明分子中有3种氢原子
(5)请设计由乙醇和丙酸为原料合成化合物X的路线,(用流程图表示,试剂任选)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com