
【题目】下列有关反应限度的叙述正确的是
A. 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
B. 依据焓判据:NH4HCO3受热分解可自发进行
C. 大多数化学反应在一定条件下都有一定的限度
D. FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)下列描述能说明该可逆反应达到化学平衡状态的有___。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3molH-H键断裂,有6molN-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变
(2)若起始时向容器中充入10mol·L-1的N2和15mol·L-1的H2,10min时测得容器内NH3的浓度为1.5mol·L-1。10min内用N2表示的反应速率为___;此时H2的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。
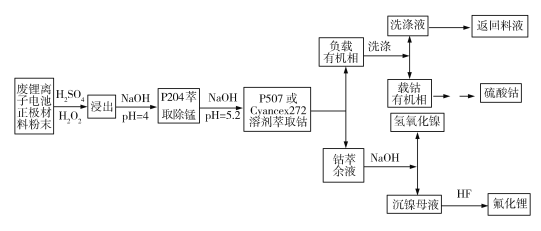
已知:P204[二(2乙基己基)磷酸酯]常用于萃取锰,P507(2乙基己基膦酸2乙基己酯)和Cyanex272[二(2,4,4)三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式__________________________________。
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:
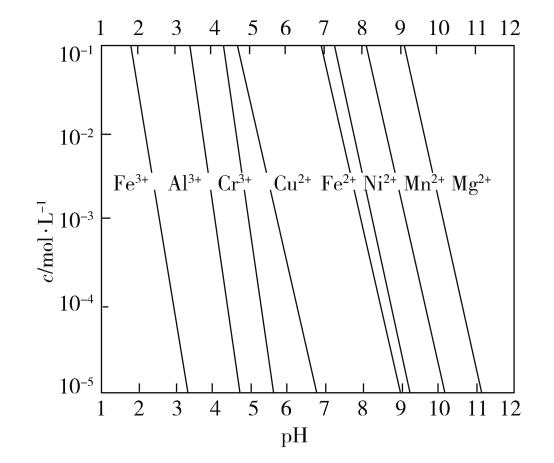
加入NaOH溶液调pH=5可除去图中的________(填金属离子符号)杂质;写出除去金属离子的离子方程式________________________(一种即可)。
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)![]() MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)![]() MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________。
MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________。
(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。
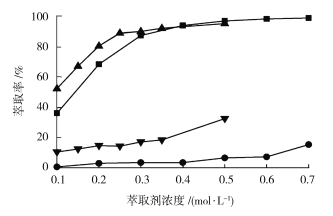
■—Co(Cyanex272);●—Ni(Cyanex272);▲—Co(P507);▼—Ni(P507)
由图可知,钴、镍的萃取率随萃取剂浓度增大而_________(填“增大”或“减小”);两种萃取剂中___________(填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为__________mol·L1;若选Cyanex272萃取剂,则最适宜的萃取剂浓度大约为___________mol·L1。
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×1016,则沉镍母液中Ni2+的浓度为2.1×1011 mol·L1时,pH=______(lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是
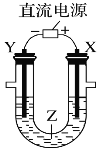
A. 氯碱工业中,X电极上反应式是4OH--4e-=2H2O+O2↑
B. 电解精炼铜时,Z溶液中的铜离子浓度不变
C. 在铁片上镀铜时,Y是纯铜
D. 电解水制氢气时,Z可以是稀硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有如下两个反应:(A)NaOH+HCl=NaCl+H2O;(B)2FeCl3+Cu=2FeCl2+CuCl2,根据两反应本质,判断能设计成原电池的反应是___(填字母)。
(2)选择适宜的材料和试剂将(1)中你的选择设计为一个原电池。写出电池的正极电极反应式___。
(3)氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内部的新型发电装置,是一种具有应用前景的绿色电源。如图为氢氧燃料电池原理示意图,按照此图的提示回答下列问题:
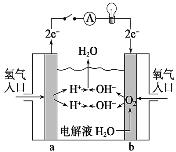
①该燃料电池的负极是___(填“a”或“b”)。
②___(填化学式)发生还原反应。
③总反应式是___。
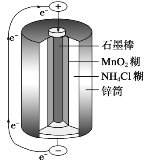
(4)锌锰干电池是最早使用的化学电池,其基本构造如图所示:锌锰干电池的负极是锌(Zn),电路中每通过0.4mole-,负极质量减少___g;工作时NH![]() 在正极放电产生两种气体,其中一种气体分子是10e-的微粒,正极的电极反应式是___。
在正极放电产生两种气体,其中一种气体分子是10e-的微粒,正极的电极反应式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O △H<0
Cr2O72-+H2O △H<0
(1)该反应平衡常数的表达式为_______________________
(2)下列说法正确的是_________
A、V正(CrO42—)=2V逆(Cr2O72—)说明该反应已达平衡状态
B、溶液颜色不变说明该反应已达平衡状态
C、溶液中c(CrO42—):c(Cr2O72—)=2:1时该反应已达平衡状态
D、升温该反应平衡常数变大
E、向平衡后的体系中加入一定量的水,平衡不移动
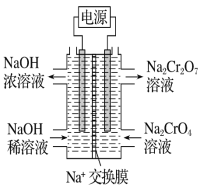
(3)根据2CrO42-+2H+![]() Cr2O72-+H2O设计图示装置(两极均为惰性电极)电解Na2CrO4 溶液制取Na2Cr2O7图中右侧电极连接电源的______极,其电极反应式为______________
Cr2O72-+H2O设计图示装置(两极均为惰性电极)电解Na2CrO4 溶液制取Na2Cr2O7图中右侧电极连接电源的______极,其电极反应式为______________
(4)H+(aq)+OH-(aq)=H2O(l);ΔH= -a KJ/mol
3Cl2(g)+2Cr3+(aq)+16OH-(aq)=2CrO42-(aq)+6Cl-(aq)+8H2O(l);ΔH= -b KJ/mol
2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l);ΔH= -c KJ/mol
Cr2O72-(aq)+H2O(l);ΔH= -c KJ/mol
已知酸性条件下Cr2O72—将Cl-氧化为Cl2,本身被还原为Cr3+,试写出该反应的热化学方程式:_______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。
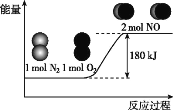
已知:断开1molN2(g)中化学键需吸收946kJ能量,断开1molO2(g)中化学键需吸收498kJ能量。下列说法正确的是( )
A.N2和O2的总能量一定高于NO的总能量
B.2NO(g)=N2(g)+O2(g),该反应为吸热反应
C.断开1molNO(g)中化学键需吸收90kJ能量
D.形成1molNO(g)中化学键可释放632kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2可用来漂白织物,其生产工艺如下图,回答下列问题:
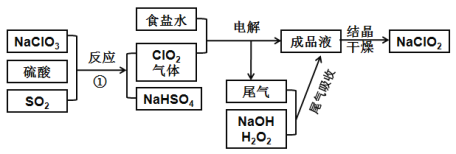
(1)图中两种氯的含氧酸盐中氯元素的化合价从高到低为____价、____价
(2)电解步骤所用食盐水由粗盐水精制而成,除去粗盐水中Mg2+、Ca2+,应加入的试剂分别为____、____
(3)写出反应①的化学方程式:__________
(4)“有效氯含量”是指每克含氯消毒剂的能力相当于多少克Cl2的氧化能力。则NaClO2的有效氯含量为:_______(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁--空气燃料电池工作原理示意图。下列有关该电池的说法不正确的是( )

A.该电池Mg作负极,发生氧化反应
B.该电池的正极反应式为:![]()
C.电池工作时,电子通过导线由Mg电极流向C电极
D.当电路中通过0.2mol电子时,消耗的![]() 体积为1.12L
体积为1.12L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com