
【题目】NaClO2可用来漂白织物,其生产工艺如下图,回答下列问题:
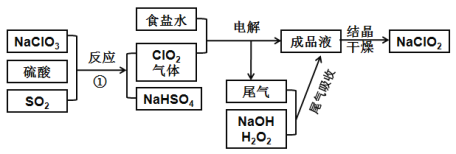
(1)图中两种氯的含氧酸盐中氯元素的化合价从高到低为____价、____价
(2)电解步骤所用食盐水由粗盐水精制而成,除去粗盐水中Mg2+、Ca2+,应加入的试剂分别为____、____
(3)写出反应①的化学方程式:__________
(4)“有效氯含量”是指每克含氯消毒剂的能力相当于多少克Cl2的氧化能力。则NaClO2的有效氯含量为:_______(计算结果保留两位小数)
【答案】+5 +3 NaOH溶液 Na2CO3溶液 2NaClO3 + SO2 + H2SO4 = 2ClO2↑ + 2NaHSO4 1.57
【解析】
化合价是元素形成化合物时表现出来的性质,在任何化合物中,所有元素正负化合价的代数和为0,由此可标注出NaClO3和NaClO2中氯元素的化合价。在书写NaClO3与SO2反应的方程式时应注意把握住该反应中氧化剂NaClO3与还原剂SO2所转移的电子数相等,由此配平书写方程式。在求算“有效氯含量”时同样可利用两种氧化剂转移电子数相等列式:4n(NaClO2)=2n(Cl2),由此解题。
(1)图中两种氯的含氧酸盐分别为NaClO3和NaClO2,其中氯元素的化合价从高到低为分别为+5价、+3价。
(2)食盐溶液中混有Mg2+、Ca2+会对电解过程产生影响,因此可利用过量的氢氧化钠溶液除去Mg2+,利用过量的碳酸钠溶液除去Ca2+,因此答案为NaOH溶液、Na2CO3溶液;
(3)①的反应是NaClO3与SO2的氧化还原反应,其化学方程式为:2NaClO3 + SO2 + H2SO4 = 2ClO2↑ + 2NaHSO4;
(4)每克NaClO2的物质的量为![]() ,依据电子转移数目相等,可知氯气的物质的量为
,依据电子转移数目相等,可知氯气的物质的量为![]() ,则氯气的质量为0.022mol×71g/mol=1.57g。
,则氯气的质量为0.022mol×71g/mol=1.57g。


科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
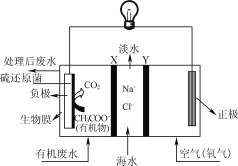
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应限度的叙述正确的是
A. 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
B. 依据焓判据:NH4HCO3受热分解可自发进行
C. 大多数化学反应在一定条件下都有一定的限度
D. FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+3B=2C+D在四种不同情况下的反应速率分别为①v(A)=0.15mol·L-1·s-1 ②v(B)=0.6mol·L-1·s-1 ③v(C)=0.5mol·L-1·min-1 ④v(D)=0.45mol·L-1·s-1。则反应进行由快到慢的顺序为( )
A.④>③>①>②B.④>②>①>③
C.②>③>④>①D.④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神舟七号”成功登天标志着我国的航天事业进入了新的篇章。
(1)某空间站局部能量转化系统如下图所示,其中燃料电池采用KOH溶液为电解液,燃料电池放电时的负极反应式为___________________________________。如果某段时间内氢氧储罐中共收集到33.6 L(已折算成标况)气体,则该段时间内水电解系统中转移电子的物质 的量为_________mol。

(2)在载人航天器的生态系统中,不仅要求分离出CO2,还要求提供充足的O2。某种电化学装置可实现转化2CO2 =2CO+O2,CO可用作燃料。已知该反应的阳极反应式为4OH--4e-=O2↑+2H2O,则阴极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有H+、Mg2+、Al3+三种阳离子,逐滴加入0.1mol/L NaOH溶液,消耗NaOH溶液体积和生成沉淀关系如图,则下列说法正确的是( )
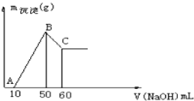
A. 横坐标为0-50mL时,所有反应为:Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓
B. B点生成沉淀的总物质的量0.02mol
C. 若往C点的溶液中加入足量盐酸,沉淀将全部溶解
D. H+、Mg2+、Al3+三种阳离子物质的量浓度之比为:2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸配制1.0mol/L硫酸溶液480mL,回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 ______(填字母),配制上述溶液还需用到的玻璃仪器是_________(填仪器名称)。

(2)容量瓶上标有以下5项中的_____(填序号)
①压强 ②温度 ③容量 ④浓度 ⑤刻度线
(3)在配制过程中,下列操作使所配溶液浓度偏大的是__________ .
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
③定容时,仰视刻度线
④使用容量瓶前用蒸馏水洗涤且没干燥
(4)计算实验室配制上述溶液需用量筒量取质量分数为98%、密度为1.84g/mL的浓硫酸的体积为:_____mL。(保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A.原子序数:Y>X>Z>WB.离子半径:X+>Y2+>Z->W2-
C.原子最外层电子数:Z>W>Y>XD.还原性:X>Y,W2->Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为104,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:

(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是______________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒______________。
(2)提取过程不可选用明火直接加热,原因是______________,与常规的萃取相比,采用索氏提取器的优点是______________。
(3)提取液需经“蒸馏浓缩”除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是______________。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有______________(填标号)。
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯
(4)浓缩液加生石灰的作用是中和______________和吸收______________。
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com