
【题目】某溶液中含有H+、Mg2+、Al3+三种阳离子,逐滴加入0.1mol/L NaOH溶液,消耗NaOH溶液体积和生成沉淀关系如图,则下列说法正确的是( )
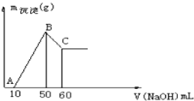
A. 横坐标为0-50mL时,所有反应为:Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓
B. B点生成沉淀的总物质的量0.02mol
C. 若往C点的溶液中加入足量盐酸,沉淀将全部溶解
D. H+、Mg2+、Al3+三种阳离子物质的量浓度之比为:2:2:1
【答案】C
【解析】
根据图象知,横坐标为0-10mL时发生的反应是:H++OH-=H2O,加入10mLNaOH溶液所中和氢离子为:n(H+)=n(NaOH)=0.01L×0.1mol/L=0.001mol;横坐标为50-60mL时,发生的化学反应是:Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3完全溶解消耗10mLNaOH溶液,由方程式可知n[Al(OH)3]=n(NaOH)=0.01L×0.1mol/L=0.001mol,再根据铝元素守恒可知,n(Al3+)=n[Al(OH)3]=0.001mol;横坐标为10-50mL时发生的化学反应是:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,沉淀为最大值时,该阶段消耗40mLNaOH溶液,根据元素-守恒,2n[Mg(OH)2]+3n[Al(OH)3]=n(NaOH),故2n[Mg(OH)2]+0.003=0.04L×0.1mol/L,故n[Mg(OH)2]=0.0005mol,以此解题。
A. 横坐标为0-50mL时,所有反应为:0-10mL时,H++OH-= H2O;10-50mL时,Mg2++2OH-=Mg(OH)2↓ 、Al3++3OH-=Al(OH)3↓,A项错误;
B. B点生成沉淀为Mg(OH)2、Al(OH)3的总物质的量为n[Al(OH)3]+ n[Mg(OH)2]=0.001mol+0.0005mol=0.0015mol,B项错误;
C. 若往C点的溶液中加入足量盐酸,Mg(OH)2+2HCl=MgCl2+2H2O、NaAlO2+4HCl=NaCl+AlCl3+2H2O,将全部溶解,C项正确;
D. 经计算,溶液中H+、Mg2+、Al3+三种阳离子物质的量浓度之比为:0.001mol:0.0005mol:0.001mol,即2:1:2,D项错误;
答案应选C。


科目:高中化学 来源: 题型:
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g) ![]() 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g) ![]() N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s)![]() CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
D.N2(g)+3H2(g) ![]() 2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O △H<0
Cr2O72-+H2O △H<0
(1)该反应平衡常数的表达式为_______________________
(2)下列说法正确的是_________
A、V正(CrO42—)=2V逆(Cr2O72—)说明该反应已达平衡状态
B、溶液颜色不变说明该反应已达平衡状态
C、溶液中c(CrO42—):c(Cr2O72—)=2:1时该反应已达平衡状态
D、升温该反应平衡常数变大
E、向平衡后的体系中加入一定量的水,平衡不移动
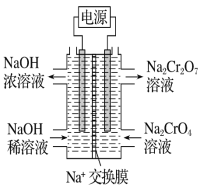
(3)根据2CrO42-+2H+![]() Cr2O72-+H2O设计图示装置(两极均为惰性电极)电解Na2CrO4 溶液制取Na2Cr2O7图中右侧电极连接电源的______极,其电极反应式为______________
Cr2O72-+H2O设计图示装置(两极均为惰性电极)电解Na2CrO4 溶液制取Na2Cr2O7图中右侧电极连接电源的______极,其电极反应式为______________
(4)H+(aq)+OH-(aq)=H2O(l);ΔH= -a KJ/mol
3Cl2(g)+2Cr3+(aq)+16OH-(aq)=2CrO42-(aq)+6Cl-(aq)+8H2O(l);ΔH= -b KJ/mol
2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l);ΔH= -c KJ/mol
Cr2O72-(aq)+H2O(l);ΔH= -c KJ/mol
已知酸性条件下Cr2O72—将Cl-氧化为Cl2,本身被还原为Cr3+,试写出该反应的热化学方程式:_______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述不正确的是( )
4NO(g)+6H2O(g),下列叙述不正确的是( )
①平衡时,υ正(O2)=υ逆(O2)必成立
②关系式5υ正(O2)=4υ逆(NO)总成立
③用上述四种物质NH3、O2、NO、H2O表示正反应速率的数值中,υ正(H2O)最大
④若投入4molNH3和5molO2,通过控制外界条件,必能生成4molNO
A.①②B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2可用来漂白织物,其生产工艺如下图,回答下列问题:
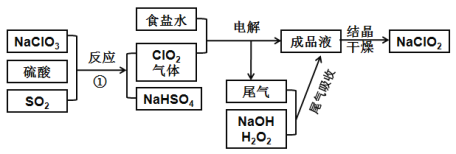
(1)图中两种氯的含氧酸盐中氯元素的化合价从高到低为____价、____价
(2)电解步骤所用食盐水由粗盐水精制而成,除去粗盐水中Mg2+、Ca2+,应加入的试剂分别为____、____
(3)写出反应①的化学方程式:__________
(4)“有效氯含量”是指每克含氯消毒剂的能力相当于多少克Cl2的氧化能力。则NaClO2的有效氯含量为:_______(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.0mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。请按要求填空:
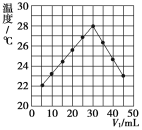
该实验表明此反应__(填“吸收”或“释放”)能量,即:__能可以转化为__能,通过示意图分析可以得出:做该实验时,环境温度__(填“高于”“低于”或“等于”)22℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去) A ![]() B
B ![]() C
C ![]() D
D
I、若A是一种黄色固体单质;B为酸雨的成因之一,且可使品红溶液褪色,回答以下问题:
(1)将B通入KMnO4溶液的现象为:_____;体现B的____(选填“氧化性”“还原性”“漂白性”);
(2)请写出D的浓溶液与单质铜反应的化学方程式:_____.
Ⅱ、若A气体可使湿润的红色石蕊试纸变蓝,则回答下列问题
(1)写出A→B的化学反应方程式_________
(2)实验室常用图所示装置制取并收集A气体,请在框中画出实验室收集A气体的装置图_____
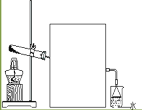
(3)尾气处理装置中使用倒扣漏斗的作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)金刚石、晶体硅、碳化硅,属于____晶体,其熔化时克服的微粒间的作用力是______。
(2)HF、HBr、HI形成的晶体,沸点由高到低的顺序为:_______________。
(3)NH3易液化,解释原因:_______,NH3分子的空间构型为____________。
(4)MgO的熔点比CaO的高,其原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com