
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧沉淀,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子B.Cl- 一定存在,且c(Cl-)≥0.4mol/L
C.SO42- 、NH4+一定存在,Cl- 可能不存在D.K+、CO32-一定不存在
【答案】B
【解析】
某溶液可能含有Cl-、SO42、CO32、NH4+、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,说明含有NH4+,n(NH4+) = 0.02mol;同时产生红褐色沉淀,说明含有Fe3+,不含CO32;过滤,洗涤,灼烧沉淀,得到1.6g固体即为氧化铁且物质的量![]() ,n(Fe3+) = 0.02mol;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀即为BaSO4且物质的量
,n(Fe3+) = 0.02mol;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀即为BaSO4且物质的量![]() ,n(SO42) = 0.02mol;根据溶液呈电中性得出一定含有Cl-,3n(Fe3+) + n(NH4+) = 2n(SO42) + n(Cl-),3×0.02mol + 0.02mol = 2×0.02mol + n(Cl-),n(Cl-) = 0.04mol,可能含有K+,因此n(Cl-) ≥ 0.04mol。
,n(SO42) = 0.02mol;根据溶液呈电中性得出一定含有Cl-,3n(Fe3+) + n(NH4+) = 2n(SO42) + n(Cl-),3×0.02mol + 0.02mol = 2×0.02mol + n(Cl-),n(Cl-) = 0.04mol,可能含有K+,因此n(Cl-) ≥ 0.04mol。
A. 根据上面分析至少存在4种离子,Cl-、SO42、NH4+、Fe3+,可能含有K+,故A错误;
B. Cl- 一定存在,根据分析得到n(Cl-) ≥ 0.04mol,即![]() ,因此c(Cl-)≥0.4molL1,故B正确;
,因此c(Cl-)≥0.4molL1,故B正确;
C. SO42- 、NH4+一定存在,根据溶液呈电中性得出Cl- 一定存在,故C错误;
D. 根据分析CO32-一定不存在,K+可能存在,故D错误。
综上所述,答案为B。


科目:高中化学 来源: 题型:
【题目】实验室需要![]() 的
的![]() 溶液,下列操作会使所配溶液浓度偏低的是( )
溶液,下列操作会使所配溶液浓度偏低的是( )
A.定容时仰视
B.容量瓶洗涤后未烘干
C.![]() 固体中混有
固体中混有![]() 固体
固体
D.将![]() 固体在烧杯中溶解后立即转移至容量瓶配制溶液
固体在烧杯中溶解后立即转移至容量瓶配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过以下流程制取 NaClO2晶体:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
已知:ClO2浓度过高时易发生分解,NaClO2高于60 ℃时易分解, NaClO2 饱和溶液在低于38 ℃时析出NaClO2·3H2O,高于38 ℃时析出 NaClO2。
下列说法不正确的是( )
A.步骤①中工业常用H2C2O4代替Na2SO3
B.步骤②发生反应的离子方程式为2ClO2+2OH-+H2O2===2ClO2-+O2+2H2O
C.步骤③的结晶方法为:蒸发浓缩,冷却结晶
D.步骤④中制得的NaClO2晶体中可用略高于38 ℃的热水洗涤2~3遍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )
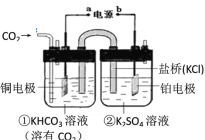
A.该过程是电能转化为化学能的过程
B.铜电极为阴极,发生还原反应
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②池中溶液的pH一定下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法正确的是 ( )
A. 升高温度可降低化学反应的活化能,使化学反应速率提高
B. 在温度、体积都相同的两容器中,分别充入相同物质的量的Br2和Cl2,让它们与等量的氢气发生反应,反应速率相同
C. 0.1 mol·L-1盐酸和0.1 mol·L-1硝酸与相同形状和大小的大理石反应的速率相同
D. 有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增加活化分子的百分数,从而使反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1:45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O,该反应的化学方程式为_____________。
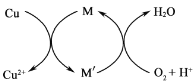
②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:
①称取样品2.2320g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25. 00mL溶液A,加入足量AgNO3溶液,得AgCl 0. 3444g;
③另取25. 00mL溶液A,调节pH 4 ~ 5,用浓度为0.08000mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液60.00mL。通过计算确定该样品的化学式(写出计算过程)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组采用氢气还原法测定碱式碳酸铜[xCuCO3·yCu(OH) 2·zH2O]的组成,反应原理为 xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y)Cu+ xCO2+(x+2y+z)H2O。 装置如下:
(x+y)Cu+ xCO2+(x+2y+z)H2O。 装置如下:

请回答:
(1)仪器 D 的名称________, D 中所装药品及目的是_______,_________;
(2)请设计实验验证硬质玻璃管 A 中的碱式碳酸铜是否完全反应___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )

A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.在Z导管出来的气体中没有二氧化碳
D.在Z导管口排出无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将 | 产生白色沉淀 | 酸性: |
B |
| 溶液变红 | 不能确定 |
C | 将 | 溴水和酸性高锰酸钾溶液均褪色 |
|
D | 向 | 开始有白色沉淀生成,后有黑色沉淀生成 |
|