
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )
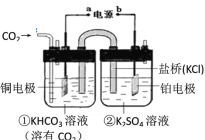
A.该过程是电能转化为化学能的过程
B.铜电极为阴极,发生还原反应
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②池中溶液的pH一定下降
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】分子式为C8H14O4的有机物在酸性条件下水解生成一种酸和一种醇,且酸和醇的物质的量之比为1:2,则符合该条件的有机物有( )(不考虑立体异构)
A.8种B.10种C.13种D.16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于甲醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。工业上常用制备Na2S2O4的方法有I锌粉法、II甲酸钠法。
Ⅰ.实验室模拟锌粉法的装置如下(加热等辅助仪器略去)
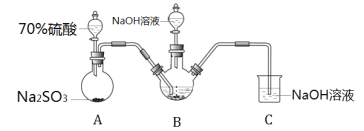
(1)第一步,将A中生成的气体通往B中进行反应,B中装的是颗粒度约为180m的锌粉与水形成的分散系,该分散系为___(填“溶液”、“胶体”或“悬浊液”)。在B装置生成连二亚硫酸锌的化学反应方程式为___。
(2)第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4和一种白色沉淀,沉淀的成分为___(写化学式)。
(3)第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出;用平衡移动的原理解释加入NaCl固体的作用是___。
第四步,过滤,用甲醇洗涤滤渣,干燥,得到Na2S2O4晶体。
II.实验室模拟甲酸钠法的装置如下(加热等辅助仪器略去)
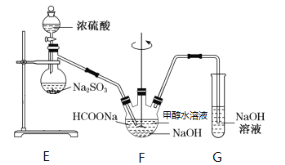
第一步,在F装置中加入甲酸钠浓溶液、氢氧化钠,甲醇(溶剂)的混合液;
第二步,向装置F中通入二氧化硫;
第三步,75℃加热一段时间,装置中有晶体析出,并产生大量气体;
第四步,过滤、洗涤、干燥,收集产品。
(4)装置F中制备连二亚硫酸钠的化学方程式可表示为___。
(5)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,H2CO3的电离常数为K1≈4.4×10-7,K2≈4.7×10-11。装置G用于吸收未反应完的SO2和反应产生的CO2。该温度下当G溶液中HSO3-、SO32-离子浓度相等时,溶液的pH约为___。
甲酸钠法于1968年实现工业化,继而逐渐替代了锌粉法生产连二亚硫酸钠。与锌粉法相比,甲酸钠法的优点在于___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应限度的叙述正确的是
A. 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
B. 依据焓判据:NH4HCO3受热分解可自发进行
C. 大多数化学反应在一定条件下都有一定的限度
D. FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2=H++HO2-,Ka=2.4×10-12)。下列说法错误的是( )
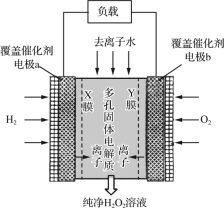
A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成1 mol H2O2电极上流过4 mol e-
D.b极上的电极反应为O2+H2O+2e-=HO2-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解等,依据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6mol·L-1,该温度下,pH=10的NaOH溶液的物质的量浓度为___。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl②NH3·H2O③H2SO4④(NH4)2SO4,其中水的电离程度由大到小顺序为___(填标号)。
(3)25℃时,将amol·L-1的醋酸和bmol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则a___b(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧沉淀,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子B.Cl- 一定存在,且c(Cl-)≥0.4mol/L
C.SO42- 、NH4+一定存在,Cl- 可能不存在D.K+、CO32-一定不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】槟榔碱(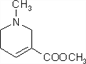 )为油状液体,有拟胆碱作用,在医疗上用于治疗青光眼。某学生设计了以X为原料的合成路线如下:
)为油状液体,有拟胆碱作用,在医疗上用于治疗青光眼。某学生设计了以X为原料的合成路线如下:
X(C5H8O2) ![]() A(C5H11O2N)
A(C5H11O2N)![]() B(C10H19O4N)
B(C10H19O4N)![]() C(C8H13O3N)
C(C8H13O3N)![]() D(C8H15O3N)
D(C8H15O3N)![]() E(
E(![]() )
)![]() F(C7H11O2N)
F(C7H11O2N)![]() G(槟榔碱)
G(槟榔碱)
已知:① X能使溴水褪色、能水解,水解产物之一为乙醇。
②CH3COOC2H5 ![]() CH3COCH2COOC2H5
CH3COCH2COOC2H5
③CH3COOH ![]() CH2BrCOOH
CH2BrCOOH
(1)C的结构简式:_________________________
(2)下列说法不正确的是:______________
A.化合物A有氨基和酯基两种官能团
B.化合物D有碱性
C.由结构推断化合物E可能溶于水
D.化合物F可以使溴水和KMnO4溶液褪色,原理相同
(3)D→E 反应的方程式:_________________________________
(4)烟酸(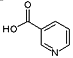 )也可以合成槟榔碱。写出符合下列条件的烟酸可能的同分异构体的结构简式____________。
)也可以合成槟榔碱。写出符合下列条件的烟酸可能的同分异构体的结构简式____________。
①含且只含有一个六元环,环上无氧原子 ②1H-NMR谱表明分子中有3种氢原子
(5)请设计由乙醇和丙酸为原料合成化合物X的路线,(用流程图表示,试剂任选)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是
A.硫酸亚铁酸性溶液加入双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O
B.向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至SO42―完全沉淀:Al3++ 2SO42―+2Ba2++4OH―=2BaSO4↓+AlO2―+2H2O
C.碳酸氢钠溶液与硫酸氢钠溶液反应:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
D.硫酸铝与足量氨水反应:Al3++3 NH3·H2O = Al(OH)3 ↓+ 3NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com