
【题目】实验室需要![]() 的
的![]() 溶液,下列操作会使所配溶液浓度偏低的是( )
溶液,下列操作会使所配溶液浓度偏低的是( )
A.定容时仰视
B.容量瓶洗涤后未烘干
C.![]() 固体中混有
固体中混有![]() 固体
固体
D.将![]() 固体在烧杯中溶解后立即转移至容量瓶配制溶液
固体在烧杯中溶解后立即转移至容量瓶配制溶液
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断正误![]() 正确的打“
正确的打“![]() ”,错误的打“
”,错误的打“![]() ”
”![]() 。
。
(1)阴、阳离子通过静电引力形成离子键____。
(2)离子化合物中一定含有金属元素____。
(3)由金属元素和非金属元素形成的化合物一定是离子化合物____。
(4)阴、阳离子间通过离子键一定能形成离子化合物____。
(5)![]() 属于离子化合物,其电子式为
属于离子化合物,其电子式为 ____。
____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H14O4的有机物在酸性条件下水解生成一种酸和一种醇,且酸和醇的物质的量之比为1:2,则符合该条件的有机物有( )(不考虑立体异构)
A.8种B.10种C.13种D.16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒中的新药。合成丁苯酞(J)的一种路线如图所示:
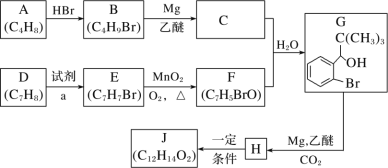
已知:
(1)B 的化学名称是_____,F 中含氧官能团名称是_____。
(2)由 E 生成 F 和 H 生成J 的反应类型分别是_____、_____。
(3)试剂 a 是_____。
(4)J 是一种环酯,则J 的结构简式为_____。H 在一定条件下还能生成高分子化合物 K,H 生成K 的化学方程式为:_____________________。
(5)M 的组成比 F 多 1 个 CH2 基团,M 的分子式为 C8H7BrO,M 的同分异构体①能发生银镜反应;②含有苯环;③不含甲基。满足上述条件的M 的同分异构体共有_____种。
(6)利用题中信息写出以乙醛和苯为原料,合成![]() 的流程图(其他试剂自选)。______________
的流程图(其他试剂自选)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向如图所示装置中分别通入等质量的![]() 四种气体(已知:密封隔板Ⅰ、Ⅱ、Ⅲ、Ⅳ可自由滑动,且与容器内壁摩擦不计),下列说法中正确的是( )
四种气体(已知:密封隔板Ⅰ、Ⅱ、Ⅲ、Ⅳ可自由滑动,且与容器内壁摩擦不计),下列说法中正确的是( )
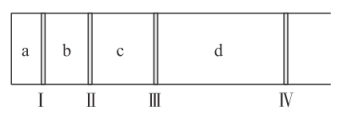
A.![]() 中装的是
中装的是![]() B.
B.![]() 和
和![]() 中气体物质的量之比为
中气体物质的量之比为![]()
C.![]() 和
和![]() 中气体分子数相等D.
中气体分子数相等D.![]() 和
和![]() 中气体密度之比为
中气体密度之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的反应判断,下列说法中错误的是
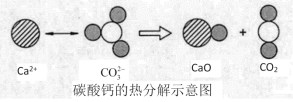
A.该反应的△H大于0
B.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
C.化学键断裂吸收能量,化学键形成放出能量
D.由该反应可推知:凡是需要加热才能发生的反应均为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于甲醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。工业上常用制备Na2S2O4的方法有I锌粉法、II甲酸钠法。
Ⅰ.实验室模拟锌粉法的装置如下(加热等辅助仪器略去)
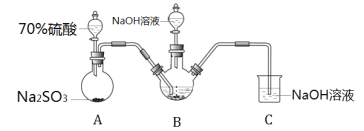
(1)第一步,将A中生成的气体通往B中进行反应,B中装的是颗粒度约为180m的锌粉与水形成的分散系,该分散系为___(填“溶液”、“胶体”或“悬浊液”)。在B装置生成连二亚硫酸锌的化学反应方程式为___。
(2)第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4和一种白色沉淀,沉淀的成分为___(写化学式)。
(3)第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出;用平衡移动的原理解释加入NaCl固体的作用是___。
第四步,过滤,用甲醇洗涤滤渣,干燥,得到Na2S2O4晶体。
II.实验室模拟甲酸钠法的装置如下(加热等辅助仪器略去)
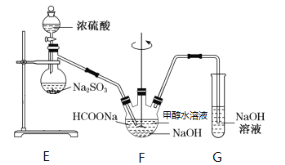
第一步,在F装置中加入甲酸钠浓溶液、氢氧化钠,甲醇(溶剂)的混合液;
第二步,向装置F中通入二氧化硫;
第三步,75℃加热一段时间,装置中有晶体析出,并产生大量气体;
第四步,过滤、洗涤、干燥,收集产品。
(4)装置F中制备连二亚硫酸钠的化学方程式可表示为___。
(5)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,H2CO3的电离常数为K1≈4.4×10-7,K2≈4.7×10-11。装置G用于吸收未反应完的SO2和反应产生的CO2。该温度下当G溶液中HSO3-、SO32-离子浓度相等时,溶液的pH约为___。
甲酸钠法于1968年实现工业化,继而逐渐替代了锌粉法生产连二亚硫酸钠。与锌粉法相比,甲酸钠法的优点在于___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧沉淀,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子B.Cl- 一定存在,且c(Cl-)≥0.4mol/L
C.SO42- 、NH4+一定存在,Cl- 可能不存在D.K+、CO32-一定不存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com