
【题目】电化学法还原二氧化碳,不仅能缓解温室效应还能得到乙烯。回答下列问题:
(1)已知:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=-45.8kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH2=-1277.0kJ·mol-1
则2CO2(g)+2H2O(g)=C2H4(g)+3O2(g)ΔH3=____。
(2)电化学法还原二氧化碳为乙烯原理如图所示。
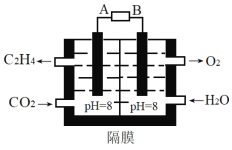
A为电源的___极(填“正”或“负”),阴极电极反应式为___。电路中转移0.2mol电子,理论上产生氧气___L(标准状况)。
(3)铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是___(填标号)。
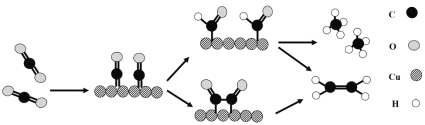
A.铜是二氧化碳转化为乙烯的催化剂
B.二氧化碳还原产物有甲烷和乙烯
C.两个反应历程都是先加氢再除氧
D.两个反应历程都出现碳氧键的断裂与碳碳键的形成
【答案】+1322.8kJ·mol-1 负 2CO2+8H2O+12e-=C2H4+12OH- 1.12 C
【解析】
(1)结合已知信息,根据盖斯定律解答;
(2)根据图知,加入水的电极上失电子生成氧气,则该电极为阳极,则通入二氧化碳的电极为阴极,连接阴极的电极为原电池负极,阴极上二氧化碳得电子和水生成乙烯和氢氧根离子;每生成1mol氧气转移4mol电子,据此计算转移0.2mol电子生成的氧气体积;
(3)A.根据图知,二氧化碳先和Cu反应,最后又生成Cu;
B.二氧化碳在反应中得电子发生还原反应,根据图知,二氧化碳还原产物还有甲烷;
C.生成乙烯是先除去氧后加氢;
D.两个反应历程中都有碳氧键的断裂和碳氢键的形成。
(1)①C2H4(g)+H2O(g)═C2H5OH(g)△H1=-45.8 kJ/mol
②C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H2=-1277.0 kJ/mol
根据盖斯定律,-(①+②)得方程式:2CO2(g)+2H2O(g)═C2H4(g)+3O2(g)△H3=(45.81277.0)kJ/mol=+1322.8 kJ/mol;
(2)根据图知,加入水的电极上失电子生成氧气,则该电极为阳极,则通入二氧化碳的电极为阴极,连接阴极的电极为原电池负极,则A为负极,阴极上二氧化碳得电子和水生成乙烯和氢氧根离子,电极反应式为2CO2+8H2O+12e=C2H4+12OH;每生成1mol氧气转移4mol电子,据此计算转移0.2mol电子生成的氧气体积=![]() ×1mol×22.4L/mol=1.12L;
×1mol×22.4L/mol=1.12L;
(3)A.根据图知,二氧化碳先和Cu反应,最后又生成Cu,则Cu作催化剂,故A正确;
B.二氧化碳在反应中得电子发生还原反应,根据图知,二氧化碳还原产物还有甲烷,所以二氧化碳反应还原产物有乙烯和甲烷,故B正确;
C.生成乙烯是先除去氧后加氢,而不是先除氢后除氧,故C错误;
D.两个反应历程中都有碳氧键的断裂和碳氢键的形成,形成碳氢键导致生成甲烷和乙烯,故D正确;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
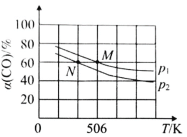
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H2=-57.3kJ/mol。下列结论中正确的是
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.稀硫酸与稀Ba(OH)2溶液反应生成2mol水,放出2×57.3kJ的热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
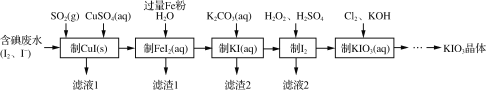
(1)检验“含碘废水”中是否含有单质I2,常用的试剂是______。
(2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为________。
(3)滤渣1的成分为______。(写化学式)
(4)“制KIO3溶液”时,发生反应的离子方程式为___________。
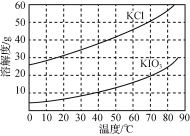
(5)KCl、KIO3的溶解度曲线如图所示。由上述流程中制得的KIO3溶液得到KIO3晶体的方法为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应限度的叙述正确的是
A. 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
B. 依据焓判据:NH4HCO3受热分解可自发进行
C. 大多数化学反应在一定条件下都有一定的限度
D. FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
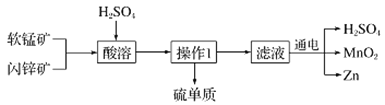
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图:
下列说法不正确的是( )
A.干电池是一种将化学能转变为电能的装置
B.酸溶时,ZnS作还原剂,每析出12.8gS沉淀,共转移0.8mol电子
C.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+
D.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解等,依据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6mol·L-1,该温度下,pH=10的NaOH溶液的物质的量浓度为___。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl②NH3·H2O③H2SO4④(NH4)2SO4,其中水的电离程度由大到小顺序为___(填标号)。
(3)25℃时,将amol·L-1的醋酸和bmol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则a___b(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学为探究![]() 与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
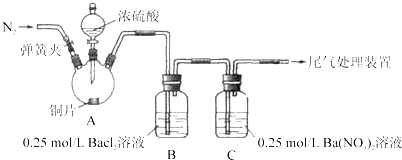
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡,B中有气泡冒出,产生大量白色沉淀,C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是_______,该沉淀的生成表明SO2具有_______性。
(3)C中液面上方生成浅棕色气体的化学方程式是______。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是____;乙在A、B间增加洗气瓶D,D中盛放的试剂是______。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下,11.2L HF含有的分子数目为0.5NA
B. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
C. 常温下,0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子数小于0.2NA
D. 18g葡萄糖(C6H12O6)分子含有的羟基数目为0.6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com