
【题目】已知反应:①101kPa时,C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H2=-57.3kJ/mol。下列结论中正确的是
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.稀硫酸与稀Ba(OH)2溶液反应生成2mol水,放出2×57.3kJ的热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ的热量
【答案】A
【解析】
A.燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物时放出的热量,反应①101kPa时,C(s)+![]() O2(g)=CO(g)△H1=-110.5kJ/mol为碳不完全燃烧,完全燃烧放出的热量比不完全燃烧放出的热量多,放热反应焓变小于0,放出的热量越多,焓变越小,若碳的燃烧热用△H3来表示,则△H3<△H1,故A正确;
O2(g)=CO(g)△H1=-110.5kJ/mol为碳不完全燃烧,完全燃烧放出的热量比不完全燃烧放出的热量多,放热反应焓变小于0,放出的热量越多,焓变越小,若碳的燃烧热用△H3来表示,则△H3<△H1,故A正确;
B.根据A项分析,则△H3<△H1,故B错误;
C.中和热是指稀溶液中强酸和强碱生成1molH2O放出的热量,稀硫酸与稀Ba(OH)2溶液反应生成2mol水,同时还生成硫酸钡沉淀,则放出大于2×57.3kJ的热量,故C错误;
D.中和热是指稀溶液中强酸和强碱生成1molH2O放出的热量,醋酸是弱酸,电离时需要吸收热量,则放出的热量小于57.3kJ,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】苯佐卡因可用于粘膜溃疡、创面等的镇痛,是一种常用的局部麻醉剂,其合成路线如下图所示![]() 已知:
已知:![]() 当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位。
当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位。
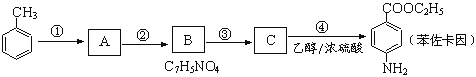
②![]()
![]()
![]()
③![]()
![]()
![]() (有若碱性,易被氧化)
(有若碱性,易被氧化)
![]() 上述合成路线中属于取代反应的是 ____________。
上述合成路线中属于取代反应的是 ____________。![]() 填代号
填代号![]() 。化合物C中含有的含氧官能团的名称为 _____________。
。化合物C中含有的含氧官能团的名称为 _____________。
![]() 合成路线中反应
合成路线中反应![]() 的化学方程式为 _______________________________________。
的化学方程式为 _______________________________________。
![]() 下列关于上述合成路线的说法中正确的是 ____________。
下列关于上述合成路线的说法中正确的是 ____________。![]() 填字母
填字母![]()
![]() 反应
反应![]() 除主要生成物质A外,还可能生成
除主要生成物质A外,还可能生成![]() 、
、 等
等
![]() 步骤
步骤![]() 和
和![]() 可以互换
可以互换
![]() 反应
反应![]() 是还原反应
是还原反应
![]() 苯佐卡因有多种同分异构体,请写出其中任意一种满足下列条件的同分异构体的结构简式: _______________。
苯佐卡因有多种同分异构体,请写出其中任意一种满足下列条件的同分异构体的结构简式: _______________。
![]() 有两个对位取代基;
有两个对位取代基;![]() 直接连在苯环上;
直接连在苯环上;![]() 分子结构中含有酯基。
分子结构中含有酯基。
![]() 化合物
化合物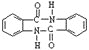 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图______。提示:
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图______。提示:![]() 合成过程中无机试剂任选;
合成过程中无机试剂任选;![]() 合成路线流程图示例如下:
合成路线流程图示例如下: ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约![]() ,在低于
,在低于![]() 时,泡沫具有永久磁性,下列叙述正确的是( )
时,泡沫具有永久磁性,下列叙述正确的是( )
A.“碳纳米泡沫”是一种胶体
B.“碳纳米泡沫”是一种新型的碳化合物
C.“碳纳米泡沫”在一定条件下能吸引磁铁
D.“碳纳米泡沫”与石墨的相互转化不属于化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成分为Fe(CrO2)2],含有Al2O3、Fe2O3、SiO2等杂质为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下,关于该流程说法错误的是( )

A.煅烧生成Na2CrO4的化学方程式为:4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4 +8CO2
2Fe2O3+8Na2CrO4 +8CO2
B.SiO2在“浸出过滤”步骤中和Fe2O3一起除去
C.Na2CrO4到Na2Cr2O7转化的原理为:2H++2CrO42-![]() Cr2O72-+H2O
Cr2O72-+H2O
D.该工艺中“煅烧”产生的CO2可用于“除杂”步骤以节约生产成本,为完全除去AlO2-,发生的离子反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了一种电解法制取Fe(OH)2的实验装置(如图),分别用铁棒和碳棒作电极,通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中错误的是
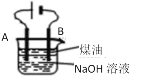
A.NaOH溶液加热煮沸以除去其中溶解氧
B.A电极用碳棒,B电极用铁棒
C.B电极发生的反应是:2H2O+2e- = H2↑+ 2OH-
D.电解池中的电解液也可以用NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物等大气污染物对打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g),其反应历程分两步:
2NO2(g),其反应历程分两步:
①2NO(g)![]() N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
反应历程的能量变化如图:
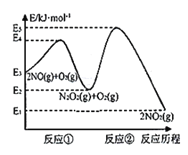
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH__0(填“>”、“<”或“=”)。
2NO2(g)的ΔH__0(填“>”、“<”或“=”)。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,E4+E2__E5+E3(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,E4+E2__E5+E3(填“>”、“<”或“=”)。
(3)一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=___。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=___。
(4)T1℃下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如图所示。前5秒内O2的平均生成速率为___;T1℃下反应2NO(g)+O2(g)![]() 2NO2(g)的化学平衡常数K=__。
2NO2(g)的化学平衡常数K=__。
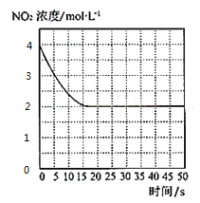
(5)对于(4)中的反应体系达平衡后,若降低温度,再次达平衡后,混合气体的平均相对分子质量___(填“增大”、“减小”或“不变”);对于(4)中的反应体系达平衡后,若在恒温恒容条件下,追加NO2,再次达平衡后,NO2的体积分数___(填“增大”、“减小”或“不变”)。
(6)对于(4)中的反应体系达平衡后(压强为P1),若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,P1︰P2 = 5︰8,则再次平衡时NO2的浓度为___mol·L-1。(精确到小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种物质的分子式相同,但分子的空间结构不同,可以实现下列转化:
1molX![]() 1molY
1molY![]() 1molZ。下列说法正确的是( )
1molZ。下列说法正确的是( )
A.物质Y比X稳定.B.物质Y比Z稳定
C.X转化为Y是放出能量D.X转化为Z是吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学法还原二氧化碳,不仅能缓解温室效应还能得到乙烯。回答下列问题:
(1)已知:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=-45.8kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH2=-1277.0kJ·mol-1
则2CO2(g)+2H2O(g)=C2H4(g)+3O2(g)ΔH3=____。
(2)电化学法还原二氧化碳为乙烯原理如图所示。
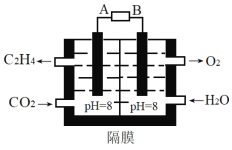
A为电源的___极(填“正”或“负”),阴极电极反应式为___。电路中转移0.2mol电子,理论上产生氧气___L(标准状况)。
(3)铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是___(填标号)。
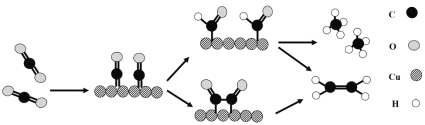
A.铜是二氧化碳转化为乙烯的催化剂
B.二氧化碳还原产物有甲烷和乙烯
C.两个反应历程都是先加氢再除氧
D.两个反应历程都出现碳氧键的断裂与碳碳键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.用惰性电极电解MgCl2溶液:2Cl-+H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B.碳酸钠溶液显碱性:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
C.氯气通入冷水中:Cl2 +H2O ![]() Cl-+ClO-+2H+
Cl-+ClO-+2H+
D.碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH= 2CH3COO-+CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com