
【题目】某同学设计了一种电解法制取Fe(OH)2的实验装置(如图),分别用铁棒和碳棒作电极,通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中错误的是
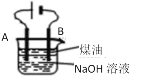
A.NaOH溶液加热煮沸以除去其中溶解氧
B.A电极用碳棒,B电极用铁棒
C.B电极发生的反应是:2H2O+2e- = H2↑+ 2OH-
D.电解池中的电解液也可以用NaCl溶液
【答案】B
【解析】
A.该电解池装置中,铁作阳极,失电子,转化为亚铁离子,与电解质溶液中的氢氧根离子结合形成氢氧化亚铁白色沉淀,氢氧化亚铁不稳定,易被氧化,故NaOH溶液加热煮沸以除去其中溶解氧,防止氢氧化亚铁氧化,故A正确;
B.利用该电解池装置制备氢氧化亚铁,铁作阳极与电源正极相连,碳作阴极,与电源负极相连,则A电极用铁棒,B电极用碳棒,故B错误;
C.B为电解池阴极,电极用碳棒,发生还原反应,B电极发生的反应是:2H2O+2e- = H2↑+ 2OH-,故C正确;
D.电解池中的电解液用NaCl溶液,根据放电顺序,阴极为电解水电极反应为2H2O+2e- = H2↑+ 2OH-,产生氢氧根,阳极铁电极失电子变为亚铁离子,二者电极产物结合可生成氢氧化亚铁,则电解池中的电解液也可以用NaCl溶液,故D正确;
答案选B。


科目:高中化学 来源: 题型:
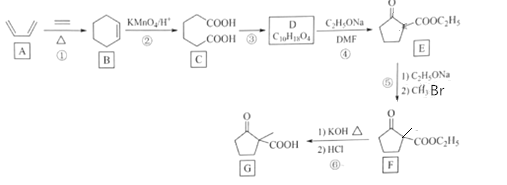
【题目】化合物G是一种药物合成中间体,其合成路线如图:
已知:R1CH2COOCH2CH3+R2COOCH2CH3![]() +CH3CH2OH
+CH3CH2OH
(1)化合物A的名称是__。
(2)反应②和⑤的反应类型分别是__、__。
(3)写出C到D的反应方程式__。
(4)E的分子式__。
(5)F中官能团的名称是__。
(6)X是G的同分异构体,X具有五元碳环结构,其核磁共振氢谱显示四组峰,且峰面积之比为6:2:1:1。写出两种符合要求的X的结构简式___。
(7)设计由乙酸乙酯和1,4-二溴丁烷制备 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H14O4的有机物在酸性条件下水解生成一种酸和一种醇,且酸和醇的物质的量之比为1:2,则符合该条件的有机物有( )(不考虑立体异构)
A.8种B.10种C.13种D.16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向如图所示装置中分别通入等质量的![]() 四种气体(已知:密封隔板Ⅰ、Ⅱ、Ⅲ、Ⅳ可自由滑动,且与容器内壁摩擦不计),下列说法中正确的是( )
四种气体(已知:密封隔板Ⅰ、Ⅱ、Ⅲ、Ⅳ可自由滑动,且与容器内壁摩擦不计),下列说法中正确的是( )
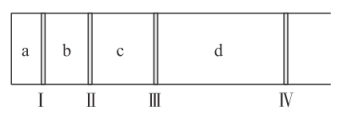
A.![]() 中装的是
中装的是![]() B.
B.![]() 和
和![]() 中气体物质的量之比为
中气体物质的量之比为![]()
C.![]() 和
和![]() 中气体分子数相等D.
中气体分子数相等D.![]() 和
和![]() 中气体密度之比为
中气体密度之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的反应判断,下列说法中错误的是
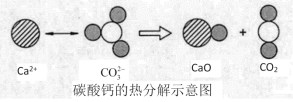
A.该反应的△H大于0
B.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
C.化学键断裂吸收能量,化学键形成放出能量
D.由该反应可推知:凡是需要加热才能发生的反应均为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H2=-57.3kJ/mol。下列结论中正确的是
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.稀硫酸与稀Ba(OH)2溶液反应生成2mol水,放出2×57.3kJ的热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于甲醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。工业上常用制备Na2S2O4的方法有I锌粉法、II甲酸钠法。
Ⅰ.实验室模拟锌粉法的装置如下(加热等辅助仪器略去)
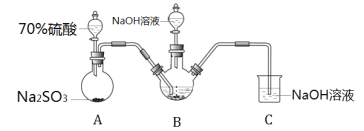
(1)第一步,将A中生成的气体通往B中进行反应,B中装的是颗粒度约为180m的锌粉与水形成的分散系,该分散系为___(填“溶液”、“胶体”或“悬浊液”)。在B装置生成连二亚硫酸锌的化学反应方程式为___。
(2)第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4和一种白色沉淀,沉淀的成分为___(写化学式)。
(3)第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出;用平衡移动的原理解释加入NaCl固体的作用是___。
第四步,过滤,用甲醇洗涤滤渣,干燥,得到Na2S2O4晶体。
II.实验室模拟甲酸钠法的装置如下(加热等辅助仪器略去)
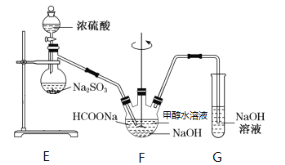
第一步,在F装置中加入甲酸钠浓溶液、氢氧化钠,甲醇(溶剂)的混合液;
第二步,向装置F中通入二氧化硫;
第三步,75℃加热一段时间,装置中有晶体析出,并产生大量气体;
第四步,过滤、洗涤、干燥,收集产品。
(4)装置F中制备连二亚硫酸钠的化学方程式可表示为___。
(5)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,H2CO3的电离常数为K1≈4.4×10-7,K2≈4.7×10-11。装置G用于吸收未反应完的SO2和反应产生的CO2。该温度下当G溶液中HSO3-、SO32-离子浓度相等时,溶液的pH约为___。
甲酸钠法于1968年实现工业化,继而逐渐替代了锌粉法生产连二亚硫酸钠。与锌粉法相比,甲酸钠法的优点在于___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应限度的叙述正确的是
A. 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
B. 依据焓判据:NH4HCO3受热分解可自发进行
C. 大多数化学反应在一定条件下都有一定的限度
D. FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】槟榔碱(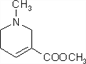 )为油状液体,有拟胆碱作用,在医疗上用于治疗青光眼。某学生设计了以X为原料的合成路线如下:
)为油状液体,有拟胆碱作用,在医疗上用于治疗青光眼。某学生设计了以X为原料的合成路线如下:
X(C5H8O2) ![]() A(C5H11O2N)
A(C5H11O2N)![]() B(C10H19O4N)
B(C10H19O4N)![]() C(C8H13O3N)
C(C8H13O3N)![]() D(C8H15O3N)
D(C8H15O3N)![]() E(
E(![]() )
)![]() F(C7H11O2N)
F(C7H11O2N)![]() G(槟榔碱)
G(槟榔碱)
已知:① X能使溴水褪色、能水解,水解产物之一为乙醇。
②CH3COOC2H5 ![]() CH3COCH2COOC2H5
CH3COCH2COOC2H5
③CH3COOH ![]() CH2BrCOOH
CH2BrCOOH
(1)C的结构简式:_________________________
(2)下列说法不正确的是:______________
A.化合物A有氨基和酯基两种官能团
B.化合物D有碱性
C.由结构推断化合物E可能溶于水
D.化合物F可以使溴水和KMnO4溶液褪色,原理相同
(3)D→E 反应的方程式:_________________________________
(4)烟酸(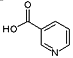 )也可以合成槟榔碱。写出符合下列条件的烟酸可能的同分异构体的结构简式____________。
)也可以合成槟榔碱。写出符合下列条件的烟酸可能的同分异构体的结构简式____________。
①含且只含有一个六元环,环上无氧原子 ②1H-NMR谱表明分子中有3种氢原子
(5)请设计由乙醇和丙酸为原料合成化合物X的路线,(用流程图表示,试剂任选)。_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com