
【题目】研究氮氧化物等大气污染物对打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g),其反应历程分两步:
2NO2(g),其反应历程分两步:
①2NO(g)![]() N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
反应历程的能量变化如图:
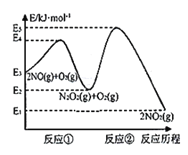
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH__0(填“>”、“<”或“=”)。
2NO2(g)的ΔH__0(填“>”、“<”或“=”)。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,E4+E2__E5+E3(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,E4+E2__E5+E3(填“>”、“<”或“=”)。
(3)一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=___。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=___。
(4)T1℃下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如图所示。前5秒内O2的平均生成速率为___;T1℃下反应2NO(g)+O2(g)![]() 2NO2(g)的化学平衡常数K=__。
2NO2(g)的化学平衡常数K=__。
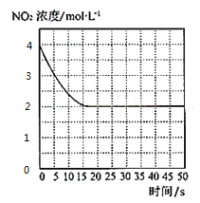
(5)对于(4)中的反应体系达平衡后,若降低温度,再次达平衡后,混合气体的平均相对分子质量___(填“增大”、“减小”或“不变”);对于(4)中的反应体系达平衡后,若在恒温恒容条件下,追加NO2,再次达平衡后,NO2的体积分数___(填“增大”、“减小”或“不变”)。
(6)对于(4)中的反应体系达平衡后(压强为P1),若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,P1︰P2 = 5︰8,则再次平衡时NO2的浓度为___mol·L-1。(精确到小数点后两位)
【答案】< < ![]() 0.1mol·L-1·s-1 1 增大 增大 2.67
0.1mol·L-1·s-1 1 增大 增大 2.67
【解析】
(1)该反应ΔH=E1-E3>0,故答案为:<;
(2)反应①的活化能为E4-E2,反应②的活化能为E5-E3,根据题意可知反应②的活化能大于反应①的活化能为,即E4-E2< E5-E3,故E4+E2<E5+E3,故答案为:<;
(3)该反应平衡常数![]() ,反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),所以
,反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),所以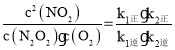 ,故答案为:
,故答案为:![]() ;
;
(4)前5s内![]() ,则v(O2)=0.1mol/(L·s)。利用三段式:
,则v(O2)=0.1mol/(L·s)。利用三段式:
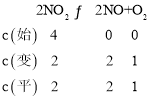
所给反应平衡常数![]() ;故答案为:0.1mol·L-1·s-1;1;
;故答案为:0.1mol·L-1·s-1;1;
(5)平均相对分子质量![]() ,反应
,反应![]() 为放热反应,降低温度,平衡右移,总质量不变,但气体总物质的量减小,故平均相对分子质量增大;恒温恒容条件下追加NO2, NO2浓度增大,根据勒夏特列原理可知虽然平衡左移,但NO2浓度依然增大,故答案为:增大;增大:
为放热反应,降低温度,平衡右移,总质量不变,但气体总物质的量减小,故平均相对分子质量增大;恒温恒容条件下追加NO2, NO2浓度增大,根据勒夏特列原理可知虽然平衡左移,但NO2浓度依然增大,故答案为:增大;增大:
(6)恒温恒容条件下,压强之比等于气体总物质的量之比,由P2,P1︰P2 = 5︰8可知充入氧气前后气体总物质的量之比为5︰8,设容器体积为V,则充入氧气前气体总物质的量为(2+2+1)V,所以再次达到平衡时物质的量为8V,设再次达到平衡时NO2浓度为amol/L,则充入氧气后反应![]() 平衡右移转化的NO为(a-2)mol/L,平衡时NO浓度为(4-a)mol/L,氧气的浓度为8-(4-a)-a=4mol/L,由于温度不变,故平衡常数K不变,K=1,所以
平衡右移转化的NO为(a-2)mol/L,平衡时NO浓度为(4-a)mol/L,氧气的浓度为8-(4-a)-a=4mol/L,由于温度不变,故平衡常数K不变,K=1,所以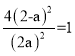 ,解得a≈2.67mol/L,故答案为:2.67。
,解得a≈2.67mol/L,故答案为:2.67。


科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M 均为短周期元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol/L)溶液的pH和原子半径的关系如图所示。下列说法不正确的是

A. X、M 简单离子半径大小顺序:X>M
B. X、Y、Z、W、M 五种元素中只有一种是金属元素
C. Z 的最高价氧化物的化学式为ZO3
D. X、Z的最简单气态氢化物反应现象:有白烟生成XY ZW
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置及操作均正确的是( )
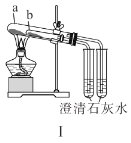
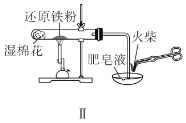

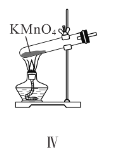
A.装置Ⅰ中![]() 盛放碳酸氢钠,
盛放碳酸氢钠,![]() 盛放碳酸钠,可对比二者的热稳定性
盛放碳酸钠,可对比二者的热稳定性
B.装置Ⅱ用于检验铁粉与水蒸气反应产生的氢气
C.装置Ⅲ用于制备氢氧化铁胶体
D.装置Ⅳ用于制备氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学用下图装置测定氧化铁样品(含![]() 和
和![]() )中
)中![]() 的质量分数,下列说法正确的是( )
的质量分数,下列说法正确的是( )
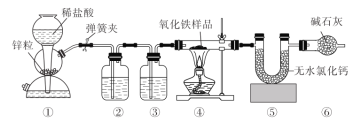
A.实验室用![]() 和浓盐酸制备
和浓盐酸制备![]() 时也可用装置①
时也可用装置①
B.实验开始时先点燃④处酒精灯,再打开弹簧夹
C.装置⑥的作用是吸收④中生成的水蒸气
D.装置②③盛装的试剂分别为![]() 溶液和浓硫酸
溶液和浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H2=-57.3kJ/mol。下列结论中正确的是
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.稀硫酸与稀Ba(OH)2溶液反应生成2mol水,放出2×57.3kJ的热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,体积均为V0且pH相同的MOH与ROH溶液,分别加水稀释至V,pH随![]() 变化如图所示。下列说法正确的是( )
变化如图所示。下列说法正确的是( )
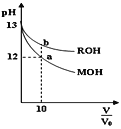
A.MOH为一元强碱
B.a点溶液的导电性大于b点溶液
C.原溶液中:c(MOH)=c(ROH)
D.水的电离程度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
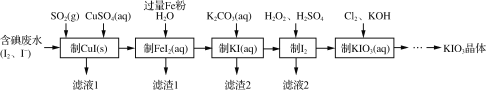
(1)检验“含碘废水”中是否含有单质I2,常用的试剂是______。
(2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为________。
(3)滤渣1的成分为______。(写化学式)
(4)“制KIO3溶液”时,发生反应的离子方程式为___________。
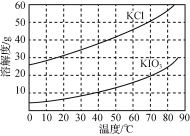
(5)KCl、KIO3的溶解度曲线如图所示。由上述流程中制得的KIO3溶液得到KIO3晶体的方法为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图:
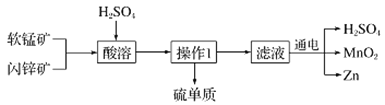
下列说法不正确的是( )
A.干电池是一种将化学能转变为电能的装置
B.酸溶时,ZnS作还原剂,每析出12.8gS沉淀,共转移0.8mol电子
C.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+
D.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芝加哥伊利诺伊大学的研究人员设计了一种可用于商业化的新型锂金属电池,电池结构如图所示: 电池工作时,下列说法错误的是
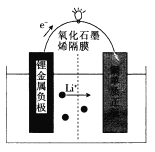
A. 该装置将化学能转化为电能
B. 负极上发生的电极反应为Li- e-= Li+
C. 该电池可用LiOH溶液作电解质
D. 电池工作时,电路中每流过1 mol电子,正极增重7g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com