
【题目】下列有关实验装置及操作均正确的是( )
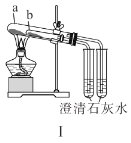

A.装置Ⅰ中![]() 盛放碳酸氢钠,
盛放碳酸氢钠,![]() 盛放碳酸钠,可对比二者的热稳定性
盛放碳酸钠,可对比二者的热稳定性
B.装置Ⅱ用于检验铁粉与水蒸气反应产生的氢气
C.装置Ⅲ用于制备氢氧化铁胶体
D.装置Ⅳ用于制备氧气
【答案】B
【解析】
A.装置Ⅰ中![]() 盛放碳酸钠,
盛放碳酸钠,![]() 盛放碳酸氢钠,由于碳酸氢钠的稳定性略差,分解需要的温度较低,碳酸钠的稳定性较强,需要加热的温度较高,可对比二者的热稳定性,故A错误;
盛放碳酸氢钠,由于碳酸氢钠的稳定性略差,分解需要的温度较低,碳酸钠的稳定性较强,需要加热的温度较高,可对比二者的热稳定性,故A错误;
B.湿棉花可以产生水蒸气,水蒸气在高温下与铁粉反应生成四氧化三铁和氢气,氢气吹入肥皂液中起泡,泡沫中是氢气,用火柴点燃,可以产生蓝色火焰,并产生轻微的爆鸣声,故B正确;
C.制备氢氧化铁胶体是将饱和三氯化铁溶液加入沸水中,如加入到氢氧化钠溶液中,会产生氢氧化铁沉淀,得不到胶体,故C错误;
D.制备氧气时用加热高锰酸钾的方法可以得到锰酸钾,二氧化锰和氧气,加热时试管口略向下倾斜,防止加热时产生的水留在试管底部,使试管炸裂,故D错误;
答案选B。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知HA的酸性强于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的物质的量浓度的负对数与溶液的pH的变化情况如图所示。下列说法正确的是
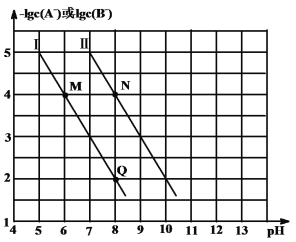
A.曲线Ⅰ表示溶液的pH与-lgc(B-)的变化关系
B.Ka(HA)∶Ka(HB)=1000∶1
C.溶液中水的电离程度:M<N
D.N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为HOOC![]() CH2—COOH,下列说法正确的是
CH2—COOH,下列说法正确的是
A. 苹果酸中能发生酯化反应的官能团有2种
B. 1mol苹果酸可与3mol NaOH发生中和反应
C. 1mol苹果酸与足量金属Na反应生成生成1mol H2
D. HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是有机物R 的结构简式,它可用于生产 S﹣诱抗素,下列关于R 的说法正确的是
( )
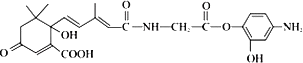
A.R 结构中含手性碳原子数多于 1 个
B.R 可以在酸性条件下充分水解生成两种有机产物
C.R 可以发生氧化、取代、加聚、缩聚反应,并能与盐酸反应生成有机盐
D.1 mol R 分别与足量NaOH 溶液、足量溴水反应,最多消耗 4 mol NaOH 和 5 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约![]() ,在低于
,在低于![]() 时,泡沫具有永久磁性,下列叙述正确的是( )
时,泡沫具有永久磁性,下列叙述正确的是( )
A.“碳纳米泡沫”是一种胶体
B.“碳纳米泡沫”是一种新型的碳化合物
C.“碳纳米泡沫”在一定条件下能吸引磁铁
D.“碳纳米泡沫”与石墨的相互转化不属于化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___。
(4)向滤液M中加入(或通入)___(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成分为Fe(CrO2)2],含有Al2O3、Fe2O3、SiO2等杂质为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下,关于该流程说法错误的是( )

A.煅烧生成Na2CrO4的化学方程式为:4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4 +8CO2
2Fe2O3+8Na2CrO4 +8CO2
B.SiO2在“浸出过滤”步骤中和Fe2O3一起除去
C.Na2CrO4到Na2Cr2O7转化的原理为:2H++2CrO42-![]() Cr2O72-+H2O
Cr2O72-+H2O
D.该工艺中“煅烧”产生的CO2可用于“除杂”步骤以节约生产成本,为完全除去AlO2-,发生的离子反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
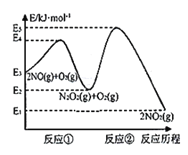
【题目】研究氮氧化物等大气污染物对打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g),其反应历程分两步:
2NO2(g),其反应历程分两步:
①2NO(g)![]() N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
反应历程的能量变化如图:
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH__0(填“>”、“<”或“=”)。
2NO2(g)的ΔH__0(填“>”、“<”或“=”)。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,E4+E2__E5+E3(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,E4+E2__E5+E3(填“>”、“<”或“=”)。
(3)一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=___。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=___。
(4)T1℃下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如图所示。前5秒内O2的平均生成速率为___;T1℃下反应2NO(g)+O2(g)![]() 2NO2(g)的化学平衡常数K=__。
2NO2(g)的化学平衡常数K=__。
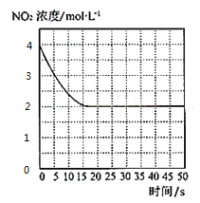
(5)对于(4)中的反应体系达平衡后,若降低温度,再次达平衡后,混合气体的平均相对分子质量___(填“增大”、“减小”或“不变”);对于(4)中的反应体系达平衡后,若在恒温恒容条件下,追加NO2,再次达平衡后,NO2的体积分数___(填“增大”、“减小”或“不变”)。
(6)对于(4)中的反应体系达平衡后(压强为P1),若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,P1︰P2 = 5︰8,则再次平衡时NO2的浓度为___mol·L-1。(精确到小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
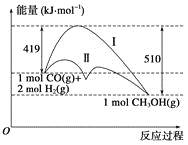
A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com