
【题目】已知HA的酸性强于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的物质的量浓度的负对数与溶液的pH的变化情况如图所示。下列说法正确的是
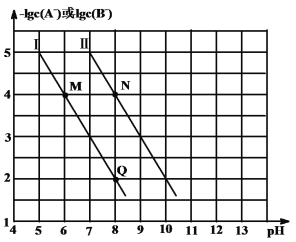
A.曲线Ⅰ表示溶液的pH与-lgc(B-)的变化关系
B.Ka(HA)∶Ka(HB)=1000∶1
C.溶液中水的电离程度:M<N
D.N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
【答案】C
【解析】
A.HA的酸性强于HB的酸性,则Ka(HA)>Ka(HB),对于HA,则Ka(HA)=![]() ,则有-lgc(A-)=-pH+pKa(HA)-lgc(HA),同理,对HB则有-lgc(B-)=-pH+pKa(HB)-lgc(HB),酸越弱,酸根离子水解越强,纵截距越大,酸越弱,所以曲线II表示pH与-1gc(B-)的关系,故A错误;
,则有-lgc(A-)=-pH+pKa(HA)-lgc(HA),同理,对HB则有-lgc(B-)=-pH+pKa(HB)-lgc(HB),酸越弱,酸根离子水解越强,纵截距越大,酸越弱,所以曲线II表示pH与-1gc(B-)的关系,故A错误;
B.对于HB,取点(10,2),则c(H+)=10-10mol/L,c(B-)=10-2mol/L,则Ka(HB)= ![]() =10-11,同理对于HA,取点(8,2),则c(H+)=10-8mol/L,c(A-)=10-2mol/L,则Ka(HA)=
=10-11,同理对于HA,取点(8,2),则c(H+)=10-8mol/L,c(A-)=10-2mol/L,则Ka(HA)= ![]() =10-9,所以Ka(HA):Ka(HB)=10-9:10-11=100,故B错误;
=10-9,所以Ka(HA):Ka(HB)=10-9:10-11=100,故B错误;
C.M点和N点溶液中c(A-)=c(B-),溶液pH越大,水的电离程度越大,所以水的电离程度M<N,故C正确;
D.对于N点溶液,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(B-),对于Q点溶液,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),N点和Q点溶液pH相同,则两溶液中c(H+)和c(OH-)分别相等,但c(B-)<c(A-),则N点对应的溶液中c(Na+)<Q点对应的溶液中c(Na+),故D错误;
答案:C


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】如图某工厂用NO气体制取NH4NO3溶液,下列说法正确的是
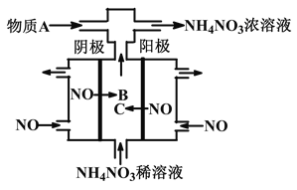
A. 阳极的电极反应式为:NO-3e-+2H2O=NO2-+4H+
B. 物质B与物质C是同一种物质
C. A物质可为氨气
D. 阴、阳两极转移的电子数之比为5∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列关于该有机物的性质说法正确的是( )
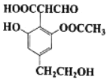
A.可与银氨溶液反应,不与![]() 溶液反应显色
溶液反应显色
B.可以与![]() 反应,1 mol该物质最多消耗
反应,1 mol该物质最多消耗![]()
C.1 mol该物质与足量金属Na反应,最多产生![]()
D.1 mol物质与NaOH溶液反应,最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672
【解析】
(1)①铁与过量稀硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+NO3-+4H+=Fe3++NO↑+2H2O;
②过量铁与稀硝酸反应生成硝酸亚铁、NO和水,离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;
③28g铁的物质的量为0.5mol,与含1.6mol硝酸的稀硝酸恰好完全反应,设生成的Fe3+和Fe2+的物质的量分别是xmol、ymol,即生成xmol硝酸铁和ymol硝酸亚铁,根据N原子守恒知,生成NO的物质的量为(1.6-3x-2y)mol,根据得失电子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,则生成的Fe3+和Fe2+的物质的量之比为2∶3;上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,由于生成的氢氧化亚铁在空气中易被氧化为氢氧化铁,氢氧化铁受热分解最终得到的固体是氧化铁,故其物质的量为0.5mol×![]() =0.25mol,质量为40g;
=0.25mol,质量为40g;
(2)①根据得失电子守恒、原子守恒及电荷守恒,可知离子方程式为10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;
②上述反应中,还原剂是Al,还原产物是N2,其物质的量之比为10∶3;由方程式可知,生成3molN2时转移电子30mol,所以反应中转移电子0.3mol,生成N2的体积(标准状况下)为![]() ×22.4L·mol-1=0.672L=672mL。
×22.4L·mol-1=0.672L=672mL。
【点睛】
金属与硝酸反应的计算一般常采用以下方法:①原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量;②得失电子守恒法:HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得到电子的物质的量等于金属失电子的物质的量;③电荷守恒法:HNO3过量时反应后溶液中(不考虑OH-)有:c(NO3-)=c(H+)+nc(Mn+)(Mn+代表金属离子);④离子方程式计算法:金属与H2SO4、HNO3的混合酸反应时,由于溶液中NO3-在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
【题型】综合题
【结束】
21
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
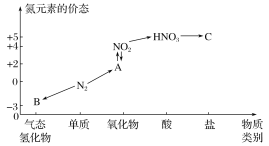
(1)写出N2的一种用途:___。
(2)HNO3与图中的物质C常用于检验Cl-的在,则C的化学式为___。
(3)实验室制取物质B的化学方程式为____。
(4)NO2与水反应生成物质A的化学方程式为____。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥管 A 中为块状白色固体,烧杯中为稀盐酸,B 中为淡黄色粉末,C 中与 B含有相同阳离子的为白色半透明结晶状的固体碱,C 的火焰反应呈黄色。并将 A、B、C 按如图所示装置连接,当打开活塞(I)(II),关闭(III)时,D 中蜡烛火焰明亮;打开活塞(I)(III)时, D 中蜡烛火焰没有明显变化;关闭活塞(I)时,A 中反应自行停止。
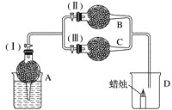
试根据上述实验事实,回答以下各问题:
(1)在装置B 中发生的化学反应是_______。
(2)在干燥管C 中的白色固体的俗名_____。写出 C 中发生化学反应的方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L水的分子数目为NA
B.标准状况下,11.2L氦气含有的原子数目为NA
C.常温常压下,48 g O3含有的氧原子数目为3NA
D.0.5 mol·L-1的MgCl2溶液中,含有Cl-的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为 A、B、C、D、E 五种含同一元素物质之间的相互转化关系。其中A、B、C、D 在常温下都是气体,且 B 为红棕色气体。
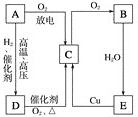
(1)①A、D、E三种物质中从相同元素化合价的角度分析既具有氧化性又具有还原性是(填化学式)____________;
②写出B的化学式:_______________, D的一种常见用途 _____________;
(2)按要求写出下列化学方程式或离子方程式
①写出 E 的稀溶液与 Cu 反应的离子方程式:_______________________;
②写出 D 的实验室制法的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M 均为短周期元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol/L)溶液的pH和原子半径的关系如图所示。下列说法不正确的是

A. X、M 简单离子半径大小顺序:X>M
B. X、Y、Z、W、M 五种元素中只有一种是金属元素
C. Z 的最高价氧化物的化学式为ZO3
D. X、Z的最简单气态氢化物反应现象:有白烟生成XY ZW
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置及操作均正确的是( )
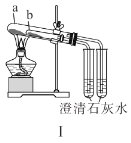
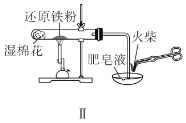

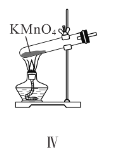
A.装置Ⅰ中![]() 盛放碳酸氢钠,
盛放碳酸氢钠,![]() 盛放碳酸钠,可对比二者的热稳定性
盛放碳酸钠,可对比二者的热稳定性
B.装置Ⅱ用于检验铁粉与水蒸气反应产生的氢气
C.装置Ⅲ用于制备氢氧化铁胶体
D.装置Ⅳ用于制备氧气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com