
【题目】某化学兴趣小组同学用下图装置测定氧化铁样品(含![]() 和
和![]() )中
)中![]() 的质量分数,下列说法正确的是( )
的质量分数,下列说法正确的是( )
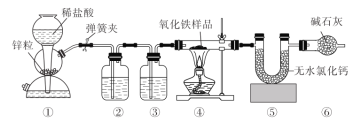
A.实验室用![]() 和浓盐酸制备
和浓盐酸制备![]() 时也可用装置①
时也可用装置①
B.实验开始时先点燃④处酒精灯,再打开弹簧夹
C.装置⑥的作用是吸收④中生成的水蒸气
D.装置②③盛装的试剂分别为![]() 溶液和浓硫酸
溶液和浓硫酸
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】新药H的一种合成路线如图:
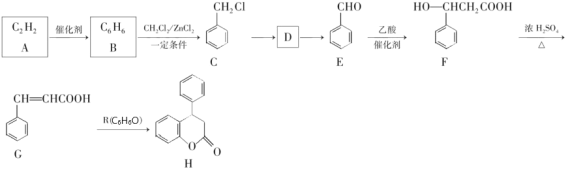
已知:A能使溴水褪色,R遇氯化铁溶液发生显色反应。
(1)R的名称是____________________;G中所含官能团名称是______________。
(2)C→D的反应条件和试剂是____________;E→F的反应类型是___________。
(3)能检验H含酯基的仪器名称是_________。A→B的原子利用率为___________。
(4)写出D→E的化学方程式:____________。
(5)在G的同分异构体中,同时满足下列条件的同分异构体有_______种。
①属于苯的衍生物;
②能发生水解反应和银镜反应;
③能与溴的四氯化碳溶液发生加成反应。
(6)参照上述合成路线,设计一条由乙烯、乙酸为原料制备![]() 的合成路线__________
的合成路线__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是有机物R 的结构简式,它可用于生产 S﹣诱抗素,下列关于R 的说法正确的是
( )
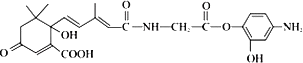
A.R 结构中含手性碳原子数多于 1 个
B.R 可以在酸性条件下充分水解生成两种有机产物
C.R 可以发生氧化、取代、加聚、缩聚反应,并能与盐酸反应生成有机盐
D.1 mol R 分别与足量NaOH 溶液、足量溴水反应,最多消耗 4 mol NaOH 和 5 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___。
(4)向滤液M中加入(或通入)___(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成分为Fe(CrO2)2],含有Al2O3、Fe2O3、SiO2等杂质为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下,关于该流程说法错误的是( )

A.煅烧生成Na2CrO4的化学方程式为:4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4 +8CO2
2Fe2O3+8Na2CrO4 +8CO2
B.SiO2在“浸出过滤”步骤中和Fe2O3一起除去
C.Na2CrO4到Na2Cr2O7转化的原理为:2H++2CrO42-![]() Cr2O72-+H2O
Cr2O72-+H2O
D.该工艺中“煅烧”产生的CO2可用于“除杂”步骤以节约生产成本,为完全除去AlO2-,发生的离子反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学对由NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
标准状况下,V(CO2) | 2.24L | 3.36L | 3.36L |
(1)盐酸的物质的量浓度为_________。
(2)混合物中,n(NaHCO3):n(KHCO3)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物等大气污染物对打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g),其反应历程分两步:
2NO2(g),其反应历程分两步:
①2NO(g)![]() N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
反应历程的能量变化如图:
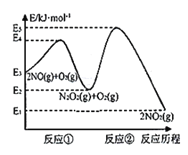
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH__0(填“>”、“<”或“=”)。
2NO2(g)的ΔH__0(填“>”、“<”或“=”)。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,E4+E2__E5+E3(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,E4+E2__E5+E3(填“>”、“<”或“=”)。
(3)一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=___。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=___。
(4)T1℃下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如图所示。前5秒内O2的平均生成速率为___;T1℃下反应2NO(g)+O2(g)![]() 2NO2(g)的化学平衡常数K=__。
2NO2(g)的化学平衡常数K=__。
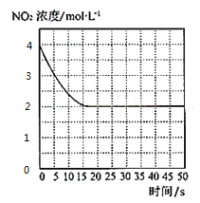
(5)对于(4)中的反应体系达平衡后,若降低温度,再次达平衡后,混合气体的平均相对分子质量___(填“增大”、“减小”或“不变”);对于(4)中的反应体系达平衡后,若在恒温恒容条件下,追加NO2,再次达平衡后,NO2的体积分数___(填“增大”、“减小”或“不变”)。
(6)对于(4)中的反应体系达平衡后(压强为P1),若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,P1︰P2 = 5︰8,则再次平衡时NO2的浓度为___mol·L-1。(精确到小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1Na2SO3溶液的pH约为10;0.1mol·L–1NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com