
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
1.92gCu片与一定量的浓HNO3作用,当收集到NO2和NO气体共1.12L时(标准状况),金属铜恰好全部作用。则:
⑴反应中消耗HNO3______mol,转移电子______mol。
⑵用排水法收集生成的气体,最后气体的体积为 L (标况)
⑶ 向收集到的气体中通入 ml O2(标况)才能使水刚好充满整个集气容器.
查看答案和解析>>
科目:高中化学 来源: 题型:
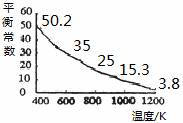
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:
I2(aq)+I-(aq)  I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
A.上述正反应为放热反应
B.上述体系中加入苯,平衡不移动
C.可运用该反应原理除去硫粉中少量的碘单质
D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
将H2(g)和I2(g)充入恒容密闭容器中,恒温下发生反应:H2(g) + I2(g)  2HI(g) ,△H<0,平衡时,I2(g)的转化率为a;若初始条件相同,绝热下发生上述反应,平衡时,I2(g)的转化率为b。则a与b的关系是( )
2HI(g) ,△H<0,平衡时,I2(g)的转化率为a;若初始条件相同,绝热下发生上述反应,平衡时,I2(g)的转化率为b。则a与b的关系是( )
A.a>b B.a=b C.a<b D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
今有①CH3COOH ②HCl ③H2SO4 三种溶液。根据要求回答下列问题:
(1)当它们PH相同时,其物质的量浓度由大到小排列是________________(填序号)
(2)当它们的物质的量浓度相同时,其PH由大到小的顺序是______________(填序号)
(3)中和等量的同一烧碱溶液,需相同的物质的量浓度的①②③三种酸溶液的体积比为
___________________________________。
(4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为_____________________;此时所得到的三种溶液的PH大小关系为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在372K时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol/L。在60s时,体系达到平衡,此时容器内的压强为开始时压强的1.6倍。下列说法正确的是 高 考 资 源 网
A 前2s 以N2O4浓度变化表示的平均反应速率为0.01mol/(L.S)
B 在2s时体系内的压强为开始时的1.1倍
C 在平衡体系内含有N2O4 0.25mol D 平衡时N2O4的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
实验中的下列操作正确的是( )
A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B.Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道
C.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com