
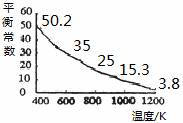
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:
I2(aq)+I-(aq)  I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
A.上述正反应为放热反应
B.上述体系中加入苯,平衡不移动
C.可运用该反应原理除去硫粉中少量的碘单质
D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
科目:高中化学 来源: 题型:
已知298 K时下列物质的溶度积(单位略)。
| CH3COOAg | AgCl | Ag2CrO4 | Ag2S | |
| Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
下列说法正确的是( )
A.等体积、浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.向含有浓度均为0.01 mol·L-1的CrO 和Cl-的溶液中慢慢滴入AgNO3溶液时,CrO
和Cl-的溶液中慢慢滴入AgNO3溶液时,CrO 先沉淀
先沉淀
C.在CH3COOAg悬浊液中加入盐酸时发生反应的离子方程式为CH3COOAg+H++Cl-===CH3COOH+AgCl
D.298 K时,上述四种饱和溶液的物质的量浓度:
c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应CO2(g) + H2(g) CO(g) + H2O(g),
CO(g) + H2O(g),
⑴写出该反应的化学平衡常数表达式:K= ▲ 。
⑵830K时,若起始时:c (CO2)=2mol/L,c (H2)=3mol/L,平衡时CO2的转化率为60%,氢气的转化率为 ▲ ;K值为 ▲ 。
⑶830K时,若只将起始时c (H2)改为6mol/L,则氢气的转化率为 ▲ 。
⑷若830K时,起始浓度c (CO2) = a mol/L,c (H2) = b mol/L,H2O的平衡浓度为c (H2O) = c mol/L,则:①a、b、c之间的关系式是 ▲ ;②当a = b时,a = ▲ c。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,Y单质化学性质不活泼,而Z能形成双原子分子,是最活泼的非金属单质。根据以上叙述,下列说法中正确的是
A.上述四种元素的原子半径大小为W<X<Y<Z
B.W、X、Y、Z原子的核外最外层电子数的总和为17
C.Z元素的最高化合价为+7价
D.Y元素的最高价氧化物的对应水化物能溶解所有的金属
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
A.原子半径:Z>Y>X
B.气态氢化物的还原性:W>R
C.WX3和水反应形成的化合物是离子化合物
D.含Z的盐溶液一定显示酸性

查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g) + Y(g)  2Z(g),△H<0,下列叙述正确的是高 考 资 源 网( )
2Z(g),△H<0,下列叙述正确的是高 考 资 源 网( )
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率:v正(X) = 2v逆(Z)
C.达到平衡后,降低温度,正反应速率减小的倍数小于逆反应减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
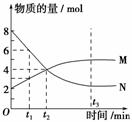
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )。
A.化学方程式为:2M N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含NA个氮原子
C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com