
【题目】最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:Na2O+2CO Na2CO3+C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
Na2CO3+C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
A.石墨烯与金刚石互为同素异形体
B.该生产石墨烯的反应中CO只体现了还原性
C.Na2O属于碱性氧化物,Na2CO3属于盐
D.自然界中碳元素有游离态和化合态两种存在形式
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】![]()
![]() ,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高
,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高![]() 转化率的是( )
转化率的是( )
A.①②④B.①④⑥C.②③⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是
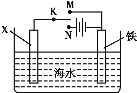
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe2e =Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 用惰性电极电解 Na2SO4溶液,当 2 mol 电子转移时,可加入 18 g 水恢复
B. 用惰性电极电解 CuSO4溶液,当加入 1 mol Cu(OH)2恢复电解前浓度时,电路中转移了 4 mol e-
C. 用惰性电极电解 1 mol CuSO4和 1 mol NaCl 的混合溶液,溶液的 pH 先减小后增大
D. 要想实现 Cu+H2SO4(稀) ═ CuSO4+H2↑的反应,需在电解池中进行,且 Cu 为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧光盘金属层中的少量Ag,某科研小组采用如下方案进行回收(金属层中其他金属含量过低,对实验的影响可忽略)。
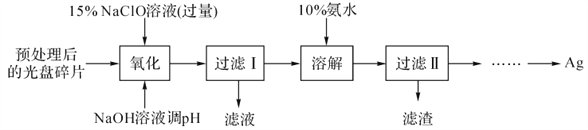
已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO =2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O =Ag(NH3)2++Cl-+2H2O
③常温时N2H4·H2O(水合肼)能还原Ag(NH3)2+:
4 Ag(NH3)2++N2H4·H2O=4Ag↓+N2↑+4NH4++4NH3↑+H2O
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为___________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为___________。HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是________________。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并________________。
(4)从“过滤Ⅱ”后的滤液中获取单质Ag的过程中,在加入2 mol/L水合肼溶液后,后续还需选用的试剂有________________(①1 mol/LH2SO4、②10%氨水、③1 mol/LNaOH溶液,填序号)。反应完全后获取纯净的单质银再进行的实验操作过程简述为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁铜及其化合物的性质,某同学设计并进行了下列实验。下列说法错误的是
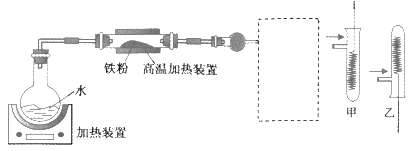
A. 高温加热装置中发生的反应为3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
B. 虚线框处宜选择的装置是甲
C. 实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑色变为红色
D. 实验后,可用铝粉在高温下还原玻璃管中的固体获得铁单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
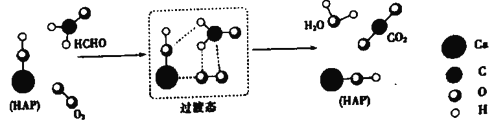
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计一个电池(如图所示),探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
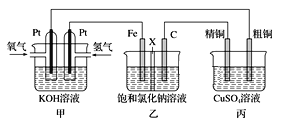
(1)通入氢气的电极为________ (填正极或负极),该电极反应式为________。
(2)石墨电极为________ (填阳极或阴极),乙中总反应离子方程式为________;如果把铁电极和石墨电极交换,乙溶液左侧出现的现象是__________________________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01mol O2,丙中精铜增重_________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
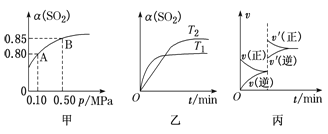
A.由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B.由图甲推断,A点对应温度下该反应的平衡常数为800L·mol-1
C.压强为0.50 MPa时不同温度下SO2转化率与温度关系如乙图,则T2>T1
D.达平衡后,若增大容器容积,则反应速率变化图像可以用图丙表示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com