
【题目】利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是
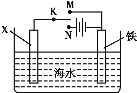
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe2e =Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e=H2↑
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3,还含有二氧化硅、氧化铝等杂质。制备流程如图所示:
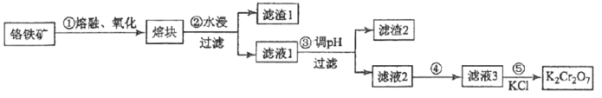
(1)步骤①的主要反应为:FeOCr2O3+NaOH+O2![]() Na2CrO4+Fe2O3+H2O 。
Na2CrO4+Fe2O3+H2O 。
上述反应配平后氧化剂与还原剂的系数比为__________。
若在实验室中进行步骤①,应该在_______中进行(填序号)
A.石英坩埚 B.铁制坩埚 C.氧化铝坩埚 D.陶瓷坩埚
(2)滤渣1中含量最多的金属元素是__________(填元素符号);滤渣2的主要成分是_________及含硅杂质;步骤③调滤液1的pH使之变_________(填“大”或“小”)
(3)向“滤液3”中加入适量KCl,经结晶过滤得到K2Cr2O7固体。步骤⑤的反应类型是___________反应。
(4)某工厂用380 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品250 kg,产率为________×100%(保留2位有效数字,M(Cr2O3)=152g/mol;M(K2Cr2O7)=294g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种燃料电池:
下面是工作原理示意图,其中正极反应生成水的是

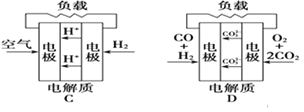
A.固体氧化物燃料电池
B.碱性氢氧化物燃料电池
C.质子交换膜燃料电池
D.熔融盐燃料电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL含HCl的AlCl3溶液中逐滴加入0.1mol·L-1的NaOH溶液,加入NaOH溶液的体积V(mL)与产生Al(OH)3沉淀的物质的量n(mol)的关系如图:

试计算:(请写出运算过程)
(1)原溶液中HCl的物质的量浓度。____________
(2)原溶液中AlCl3的物质的量浓度。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下pH为2的盐酸,下列叙述正确的是( )
A.将10mL该溶液稀释至100mL后,pH=4
B.向该溶液中加入等体积pH为12的氨水恰好完全中和
C.该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1
D.该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组在T1温度下,向容积为1L的恒容密闭容器中,同时通入0.1mol CO(g)和0.1mol H2O(g),发生反应:CO(g)+H2O(g)CO2(g)+H2(g) △H=a kJ·mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示:
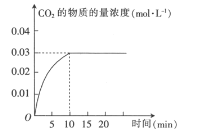
T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1、c(H2)=0.4 mol·L-1、c(CO2)=0.4 mol·L-1,则该反应在下一时刻将_______ (填“向正反应方向进行”“向逆反应方向进行”或“达到平衡”),判断依据是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:Na2O+2CO Na2CO3+C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
Na2CO3+C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
A.石墨烯与金刚石互为同素异形体
B.该生产石墨烯的反应中CO只体现了还原性
C.Na2O属于碱性氧化物,Na2CO3属于盐
D.自然界中碳元素有游离态和化合态两种存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu的单质和合金在生活、生产中有着广泛的应用。回答下列问题:
(1)Cu的基态原子价电子排布式为___。
(2)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___,反应的化学方程式为___。
(3)配离子Cu(CN)32-中,中心离子的杂化类型是___,该配离子的空间构型为___;CN-中配位原子是___(填名称)。
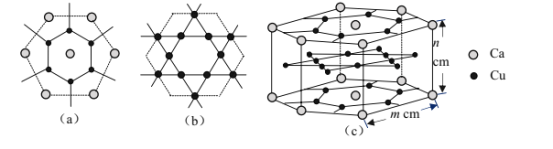
(4)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
①该晶胞中Ca有___个Cu原子配位(不一定要等距最近)。
②同一层中,Ca原子之间的最短距离是___pm,设NA为阿伏加德罗常数的值,CaCu晶体的密度是___g/cm3(用含m、n的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com