


科目:高中化学 来源: 题型:
| A、改用浓硫酸 |
| B、加入少量硫酸铜溶液 |
| C、加入氢氧化钠溶液 |
| D、加入醋酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
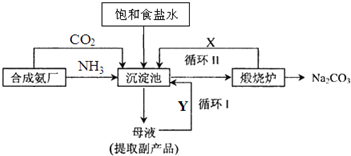
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,在半透膜袋里盛有淀粉的氯化钠溶液,将半透膜袋悬挂在蒸馏水中,回答下列问题:(知识支持:淀粉遇碘单质变蓝)
如图,在半透膜袋里盛有淀粉的氯化钠溶液,将半透膜袋悬挂在蒸馏水中,回答下列问题:(知识支持:淀粉遇碘单质变蓝)查看答案和解析>>
科目:高中化学 来源: 题型:
 柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153°C)与氢氧化铁制得.其结构如图.
柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153°C)与氢氧化铁制得.其结构如图.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com