
 海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图.
海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图.

科目:高中化学 来源: 题型:
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )| A、反应的化学方程式为:2M?3N |
| B、t2时,正、逆反应速率相等,达到平衡 |
| C、t3时,正反应速率等于逆反应速率 |
| D、t1时,N的浓度是M浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Al3+、F-、NO2- |
| B、NO2-、CrO42-、H+、Fe2+ |
| C、Mg2+、Al3+、CH2COO-、SO42- |
| D、Al3+、Na+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F均为周期表中前四周期的元素.请按要求回答下列问题.
A、B、C、D、E、F均为周期表中前四周期的元素.请按要求回答下列问题.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 1 |
| 4 |
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5(乙醚) | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
| 浓H2SO4 |
| 140℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
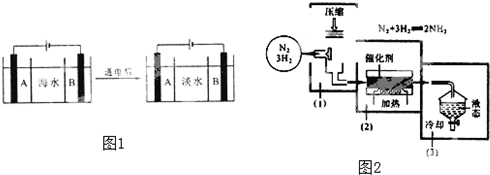
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A、在830℃,等物质的量的CO和H2O反应达到平衡时,CO的转化率为50% |
| B、在500℃时,反应达到平衡后,增大压强,化学平衡常数K减小 |
| C、恒温、恒容条件下,若混合气体的平均相对分子质量一定,不能确定可逆反应是否达到平衡 |
| D、上述正向反应是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com