
| A、1L 0.1mol?L-1的乙酸溶液中含有的氧原子数0.2NA |
| B、标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA |
| C、标准状况下,23g CH3CH2OH中含有的分子数目为0.5NA |
| D、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
| 23g |
| 46g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 280℃-300℃ |
| CuCl |
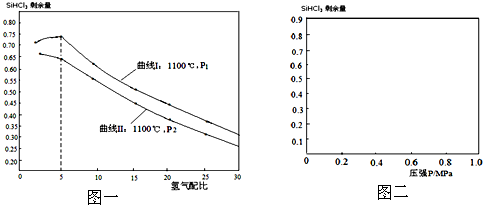
| 1100℃ |
| 物质 | BCl3 | PCl3 | SiCl4 | AsCl3 | AlCl3 | SiHCl3 |
| 沸点 | 12.1 | 73.5 | 57.0 | 129.4 | 180(升华) | 31.2 |
| H2 |
| SiHCl3 |
| 配比 剩余量 温度 |
50 | 30 | 25 | 20 | 15 | 10 | 5 | 2 |
| 775℃ | 0.8286 | 0.8476 | 0.8519 | 0.8555 | 0.8579 | 0.8570 | 0.8456 | 0.8422 |
| 1100℃ | 0.2899 | 0.3860 | 0.4169 | 0.4512 | 0.4895 | 0.5312 | 0.5707 | 0.5710 |
| H2 |
| SiHCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | 加入试剂 | 离子方程式 |
| Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应物平衡浓度较大 |
| B、反应物平衡浓度较小 |
| C、生成物平衡浓度较大 |
| D、生成物平衡浓度较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在镁、铝、稀NaOH溶液组成的原电池中,镁是负极,铝是正极 |
| B、在铁、铝、稀硫酸组成的原电池中,电子由铁片通过导线流向铝片 |
| C、在锌、铜、稀硫酸组成的原电池中,当电池工作时,硫酸根离子向正极移动 |
| D、在锌、铜、CuSO4溶液组成的原电池中,负极质量减轻,正极质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 向某溶液中先滴加少量氯水,再滴加KSCN溶液 | 溶液变成血红色 | 溶液中一定含有 Fe2+ |
| B | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 在0.1mol?L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com