
| 280℃-300℃ |
| CuCl |
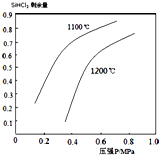
| 1100℃ |
| 物质 | BCl3 | PCl3 | SiCl4 | AsCl3 | AlCl3 | SiHCl3 |
| 沸点 | 12.1 | 73.5 | 57.0 | 129.4 | 180(升华) | 31.2 |
| H2 |
| SiHCl3 |
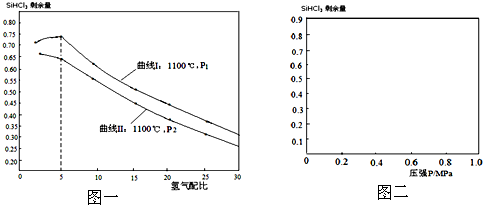
| 配比 剩余量 温度 |
50 | 30 | 25 | 20 | 15 | 10 | 5 | 2 |
| 775℃ | 0.8286 | 0.8476 | 0.8519 | 0.8555 | 0.8579 | 0.8570 | 0.8456 | 0.8422 |
| 1100℃ | 0.2899 | 0.3860 | 0.4169 | 0.4512 | 0.4895 | 0.5312 | 0.5707 | 0.5710 |
| H2 |
| SiHCl3 |
| PH2?PSiHCl3 | ||
|
| PH2?PSiHCl3 | ||
|
| 0.12mol?L-1 |
| 4min |
| 1 |
| 3 |
 ,故答案为:
,故答案为: .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、3个 | B、4个 | C、5个 | D、6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂 | 方法 | |
| 乙烷混有少量乙烯 | ||
| 溴苯混有少量溴单质 | ||
| 苯中混有少量苯酚 | ||
| 乙醇中混有少量水 | ||
| 硝酸钾中混有少量氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.1mol?L-1的乙酸溶液中含有的氧原子数0.2NA |
| B、标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA |
| C、标准状况下,23g CH3CH2OH中含有的分子数目为0.5NA |
| D、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com