


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
| A、用甲醛溶液浸泡的海鲜品 |
| B、牛奶经工业发酵后得到的酸奶 |
| C、加有苏丹红Ⅰ号调色剂的鲜辣酱 |
| D、二氧化硫熏制后的白面粉? |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
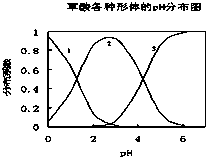 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:| c(Na+) |
| c(C2O42-) |
| c(Na+) | ||
c(C2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 部分电离的物质 | H2O | NH3?H2O(一水合氨) | HClO(次氯酸) |
| 电离产生的离子 | H+和OH- | NH4+和OH- | H+和ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
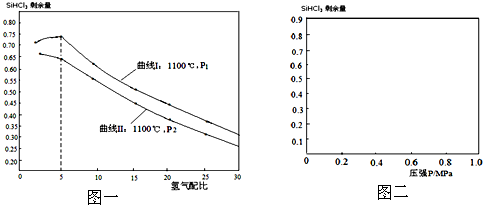
| 280℃-300℃ |
| CuCl |
| 1100℃ |
| 物质 | BCl3 | PCl3 | SiCl4 | AsCl3 | AlCl3 | SiHCl3 |
| 沸点 | 12.1 | 73.5 | 57.0 | 129.4 | 180(升华) | 31.2 |
| H2 |
| SiHCl3 |
| 配比 剩余量 温度 |
50 | 30 | 25 | 20 | 15 | 10 | 5 | 2 |
| 775℃ | 0.8286 | 0.8476 | 0.8519 | 0.8555 | 0.8579 | 0.8570 | 0.8456 | 0.8422 |
| 1100℃ | 0.2899 | 0.3860 | 0.4169 | 0.4512 | 0.4895 | 0.5312 | 0.5707 | 0.5710 |
| H2 |
| SiHCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com