
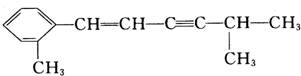
| y |
| 4 |
| 点燃 |
| y |
| 2 |
 ,
, ;
; ,
, ;
;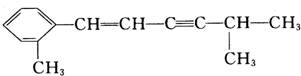 中与苯环相连的C、苯环上6个C、碳碳双键中的2个C、碳碳三键中的2个C及CH中的C一定共面,由CH上的C为四面体构型,可3个原子共面,则2个甲基中由1个C与前面12个C原子共面,即最多13个C原子共面,
中与苯环相连的C、苯环上6个C、碳碳双键中的2个C、碳碳三键中的2个C及CH中的C一定共面,由CH上的C为四面体构型,可3个原子共面,则2个甲基中由1个C与前面12个C原子共面,即最多13个C原子共面,| 1mol×114g/mol |
| 4mol |
. |
| M |
| 1mol×114g/mol |
| 3mol |
| y |
| 4 |
| 点燃 |
| y |
| 2 |
| y |
| 4 |
| 点燃 |
| y |
| 2 |
| y |
| 4 |
| y |
| 2 |
| y |
| 4 |
| y |
| 4 |


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
| A、三者的单质放置在潮湿的空气中均只生成氧化物 |
| B、制备AlCl3、FeCl3、CuCl2均可用两种单质直接化合的方法 |
| C、三者对应的氧化物均为碱性氧化物 |
| D、三者对应的氢氧化物均可由其对应的氧化物加水生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| N |
| NA |
| m |
| M |
| V |
| 22.4 |
| nB(mol) |
| V(L) |
| 1000?ρ?wB |
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
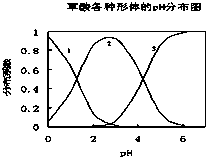 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:| c(Na+) |
| c(C2O42-) |
| c(Na+) | ||
c(C2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
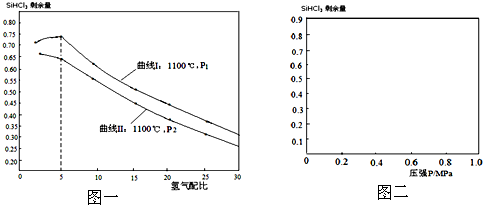
| 280℃-300℃ |
| CuCl |
| 1100℃ |
| 物质 | BCl3 | PCl3 | SiCl4 | AsCl3 | AlCl3 | SiHCl3 |
| 沸点 | 12.1 | 73.5 | 57.0 | 129.4 | 180(升华) | 31.2 |
| H2 |
| SiHCl3 |
| 配比 剩余量 温度 |
50 | 30 | 25 | 20 | 15 | 10 | 5 | 2 |
| 775℃ | 0.8286 | 0.8476 | 0.8519 | 0.8555 | 0.8579 | 0.8570 | 0.8456 | 0.8422 |
| 1100℃ | 0.2899 | 0.3860 | 0.4169 | 0.4512 | 0.4895 | 0.5312 | 0.5707 | 0.5710 |
| H2 |
| SiHCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
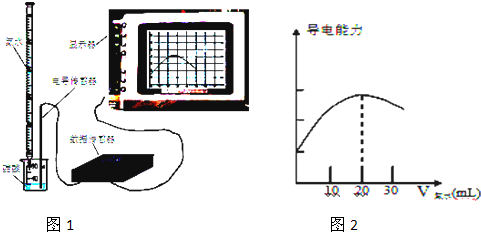
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | 加入试剂 | 离子方程式 |
| Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com