
【题目】反应N2 (g) + 3H2(g) ![]() 2NH3(g),2 min内N2浓度减少了0.6 mol﹒L-1,对此反应速率的描述正确的是( )
2NH3(g),2 min内N2浓度减少了0.6 mol﹒L-1,对此反应速率的描述正确的是( )
A. 2min内H2的反应速率是0.4 mol/(L﹒min)
B. 2 min内N2、H2、NH3的反应速率之比是1﹕2﹕3
C. 在2min内,N2的反应速率是0.3 mol/(L﹒min)
D. 在2min末NH3的反应速率是0.2 mol/(L﹒min)
【答案】C
【解析】分析:经2 min内N2浓度减少了0.6 mol﹒L-1,v(N2)=![]() =0.3 mol/(L﹒min),
=0.3 mol/(L﹒min),
化学反应速率表示单位时间内浓度的变化量;不同物质表示的速率之比等于其化学计量数之比;据此分析。
详解: 经2 min内N2浓度减少了0.6 mol﹒L-1,v(N2)=![]() =0.3 mol/(L﹒min),
=0.3 mol/(L﹒min),
A. 2min内H2的反应速率=3 v(N2)= 0.3 mol/(L﹒min)![]() 3=0.9mol/(L﹒min),故A错误;
3=0.9mol/(L﹒min),故A错误;
B.反应速率之比等于化学计量数之比,则2 min内N2、H2、NH3的反应速率之比是1﹕3﹕2,所以B选项是错误的;
C.根据以上分析,在2min内,N2的反应速率是0.3 mol/(L﹒min),故C正确;
D.化学反应速率是一段时间内的平均速率,不是瞬时速率,故D错误;
所以C选项是正确的。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素且原子序数依次増大,质子数之和为40。B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E的最高价氧化物的水化物呈两性。
(1)B元素在周期表中的位置为_______。
(2)由A、C、D三种元素组成的化合物的电子式为_______。
(3)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。現改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式______。
(4)若BA3与C2可形成燃料电池,电解质为KOH溶液,则负极的电极反应式为______。(氧化产物不污染环境)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d的原子序数依次增大,这四种元素形成的单质依次为m、n、p、q;x、y、z是由这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃时,0.01mol·L-lw溶液中,![]() =1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
=1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
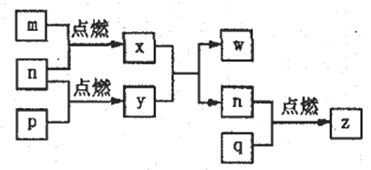
A. 原子半径的大小:a<b<c<d
B. 简单氢化物的沸点:b>d
C. y的电子式:![]()
D. y、w含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu:相对原子质量为64)。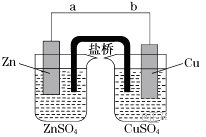
按照实验步骤依次回答下列问题:
(1)导线中电流方向为(用a、b表示)。
(2)原电池的正极为
(3)写出装置中铜电极上的电极反应式:;
(4)若装置中铜电极的质量增加32 g,则导线中转移的电子数目为;
(5)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,盐桥中的K+向(填“左侧”或“右侧”)烧杯移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]有机物F是一种香料,其合成路线如图所示:
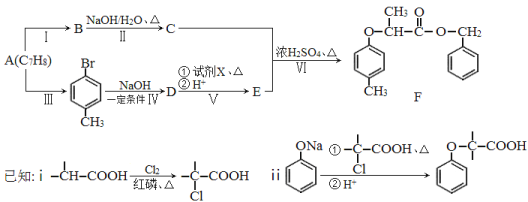
(1)A的名称为 ,试剂X的结构简式为 ,步骤Ⅵ的反应类型为 。
(2)步骤Ⅰ的反应试剂和条件分别为 、 。
(3)步骤Ⅱ反应的化学方程式为 。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有 种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子的结构简式为 。
(5)依据题中信息,完成以![]() 为原料制取
为原料制取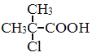 的合成路线图。
的合成路线图。
合成路线图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某城市某日空气质量报告:
污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
实验一:用下图所示装置进行实验。

(1)A装置的作用是_________(填“干燥”或“氧化”)SO2气体。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变_______色(填“蓝色”或“红色”或“不变色”),说明SO2与水反应生成一种酸。
(3)D装置的作用是_________ ,并写出化学反应方程式_____________________。
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH_______7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4。
(查阅资料) SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作_________(填“催化剂”或“氧化剂”)。
(探究结论)SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(知识联想)
(1)酸雨造成的危害是:______________________________(举一例)。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为____________,是造成酸雨的另一主要原因。
(提出建议)该市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加人_________(填“水”或“乙醇”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现通过以下步骤由 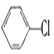 制备
制备 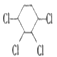
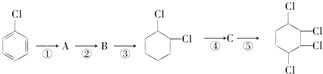
(1)写出A,B的结构简式:A , B。
(2)从左到右依次填写每步反应所属的反应类型(a.取代反应;b.加成反应;c.消去反应。只填字母代号)。
(3)写出反应A→B所需的试剂和条件:。
(4)写出④和⑤的化学方程式 , 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com