
【题目】矿盐主要成分是NaCl,还含有![]() 等其他可溶性杂质离子。下列有关说法正确的是
等其他可溶性杂质离子。下列有关说法正确的是
A.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.由矿盐生成食盐,除去![]() 最合适的试剂是
最合适的试剂是![]()
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向25.00mL 0.1 mol·L-1NaOH溶液中滴加0.1 mol·L-1甲酸(HCOOH,弱酸)溶液,所得溶液的pH和pOH[pOH=-lg c(OH-)]的关系如图所示。下列说法正确的是( )
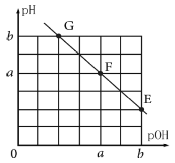
A.F点对应甲酸溶液体积V=25.00 mL
B.F点水的电离程度大于E点水的电离程度
C.温度不变,加水稀释E点溶液,c(HCOOH)/c(HCOO-)增大
D.G点对应溶液c(OH-)=102a-b mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室可用NaClO4、NH4Cl等原料制取(部分物质溶解度如图1、图2),其实验流程如图3所示,回答下列问题:
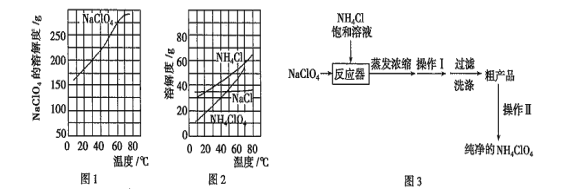
(1)反应器中发生反应的基本反应类型是____________________。
(2)上述流程中操作Ⅰ为_____,操作Ⅱ为________。
(3)已知NH4ClO4在400 ℃时开始分解为N2、Cl2、O2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略;实验开始前,已用CO2气体将整套实验装置中的空气排尽;焦性没食子酸溶液用于吸收氧气)。
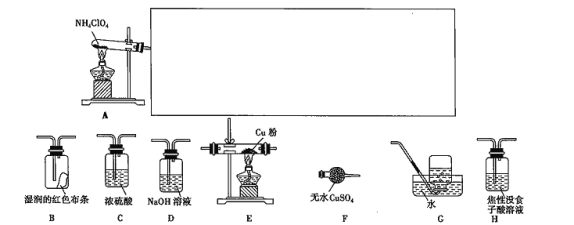
①写出高氯酸铵分解的化学方程式:_______________________。
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→_______________ (填装置的字母),证明氧气存在的实验现象为__________________。
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体。滴加蒸馏水发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒浓度关系一定正确的是( )
A.氨水与氯化铵的pH =7的混合溶液中:![]()
B.pH =2的一元酸和pH =12的一元强碱等体积混合:![]()
C.0.1molL-1的硫酸铵溶液中:![]()
D.0.1molL-1的硫化钠溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种非常重要的有机化工原料,用途十分广泛.根据所学内容填空。
I.由乙烯合成乙酸乙酯的流程如下;
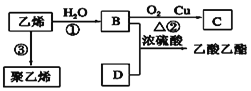
(1)写出B与D反应的化学方程式________;反应类型:_________;
(2)写出反应③的化学方程式:_________。
II.实验室用如图所示装置制备乙酸乙酯.
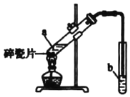
(1)实验前,向试管a中加入3mL______,然后边振荡试管边慢慢加入2mL______和2mL乙酸。
(2)试管b中盛放的试剂是饱和_____溶液。试管b中的导管不能伸入液面下的原因是____。
(3)反应结東后,从试管b中分离出乙酸乙酯的方法是______。
(4)下列描述不能说明乙醇与乙酸的反应已达到化学平衡状态的有_____(填序号)。
a.单位时间里,生成lmol乙酸乙酯,同时生成lmol水
b.单位时间区,生成lmol乙酸乙酯,同时生成1mol乙酸
c.单位时间里,消耗lmol乙醇,同时消耗1mol乙酸
d.正反应的速率与逆反应的速率相等
e.混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
①含有大量![]() 的溶液中,
的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 可以大量共存
可以大量共存
②![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 可以大量共存
可以大量共存
③向![]() 溶液中加入过量的稀氨水,发生反应:
溶液中加入过量的稀氨水,发生反应:![]()
④加入铝粉能放出![]() 的溶液中,
的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 一定能够大量共存
一定能够大量共存
⑤用NaOH溶液除去铝条表面的氧化膜:![]()
⑥依据铝热反应原理,能发生反应
⑦向明矾溶液中加入过量![]() 溶液,发生反应:
溶液,发生反应:![]()
⑧常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH溶液
A.⑤⑦B.②③⑤C.④⑤⑥D.②⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是H+)和水分子通过。其工作原理的示意图如下,请回答下列问题:

(1)该装置的能量转化形式为________。
(2)Pt(a)电极是电池________(填“正”或“负”)极;
(3)电解液中的H+向_____(填“a”或“b”)极移动;
(4)如果该电池工作时消耗1 mol CH3OH,则电路中通过___ mol电子。
(5)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3C≡CH+CH3OH+A![]() CH2=C(CH3)COOCH3,下列说法正确的是( )
CH2=C(CH3)COOCH3,下列说法正确的是( )
A.CH3OH和甘油互为同系物
B.已知该反应的原子利用率为100%,则A为CO2
C.CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D.能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com