
| A. | Fe-→FeSO4 | B. | NaCl-→AgCl | C. | CO-→CO2 | D. | Cu(NO3)2-→Cu |
科目:高中化学 来源: 题型:选择题
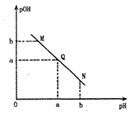 某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加人等浓度的NaOH溶液,溶液中 pOH[pOH=-lgc(OH-)]与 pH 的变化关系如,图所示,则( )
某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加人等浓度的NaOH溶液,溶液中 pOH[pOH=-lgc(OH-)]与 pH 的变化关系如,图所示,则( )| A. | M点所示溶液的导电能力强于Q点 | |
| B. | N 点所示溶液中 c(CH3COO-)>c(Na+) | |
| C. | Q点消耗NaOH溶液的体积等于醋酸溶液的体积 | |
| D. | M点和N点所示溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始瞬间HCl、H2SO4、CH3COOH反应速率相等 | |
| B. | 至反应结束时CH3COOH中放出H2的总量最多 | |
| C. | 收集相同体积的H2的CH3COOH所用时间最长 | |
| D. | 至反应结束时HCl、H2SO4收集到H2的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 刷牙时适当使用含氟牙膏能够预防龋齿 | |
| B. | 缺锌的人可以服用硫酸锌糖浆或葡萄糖酸锌等补锌 | |
| C. | 人体内缺铁会使成人患甲状腺肿大 | |
| D. | 天然蛋白质水解的产物都是α-氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性能将Fe氧化成Fe3+ |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| D | 向某溶液中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1.0 L 1.0 mol•L-1KAlO2溶液中含有的氧原子数为2 NA | |
| B. | 7.8 g Na2O2固体中含有的阴离子数为0.2 NA | |
| C. | 标准状况下,体积为2.24 L的CO2和SO2的混合气体中含有的氧原子数为0.2 NA | |
| D. | 0.1 mol Cl2参加氧化还原反应,转移的电子数目一定是0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于碘在乙醇中的溶解度较大,所以可用乙醇把碘水中的碘萃取出来 | |
| B. | 可用加热蒸馏的方法使含水乙醇变为无水乙醇 | |
| C. | 由于汽油和水不互溶,因此可用分液的方法将二者分离 | |
| D. | NaCl的溶解度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl浓溶液中分离得到纯净的NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com