
| A. | 开始瞬间HCl、H2SO4、CH3COOH反应速率相等 | |
| B. | 至反应结束时CH3COOH中放出H2的总量最多 | |
| C. | 收集相同体积的H2的CH3COOH所用时间最长 | |
| D. | 至反应结束时HCl、H2SO4收集到H2的体积相同 |
分析 A.反应速率与氢离子浓度成正比;
B.酸最终电离出的氢离子物质的量越多,生成的氢气总量越多;
C.离子浓度越小,反应速率越小,收集相同体积的氢气所用时间越长;
D.酸最终电离出的氢离子物质的量相同时,生成的氢气体积相同.
解答 解:HCl、H2SO4是强电解质而CH3COOH是弱电解质,相同pH的这三种酸浓度关系为c(CH3COOH)>c(HCl)=2c(H2SO4),相同pH、相同体积的这三种酸分别与足量Mg反应,最终电离出n(H+)大小顺序是HCl=H2SO4<CH3COOH,
A.反应速率与氢离子浓度成正比,开始时氢离子浓度相同,所以反应速率相同,故A正确;
B.酸最终电离出的氢离子物质的量越多,生成的氢气总量越多,最终醋酸电离出的n(H+)大,则最终醋酸生成的氢气多,故B正确;
C.离子浓度越小,反应速率越小,收集相同体积的氢气所用时间越长,反应中中醋酸继续电离出氢离子,而HCl、硫酸不再电离出氢离子,所以反应过程中醋酸中氢离子浓度大于盐酸和硫酸,则反应过程中醋酸反应速率大,收集相同体积的H2的CH3COOH所用时间最短,故C错误;
D.酸最终电离出的氢离子物质的量相同时,生成的氢气体积相同,最终电离出n(H+)盐酸和硫酸中相等,所以反应结束时HCl、H2SO4收集到H2的体积相同,故D正确;
故选C.
点评 本题考查弱电解质的电离,侧重考查学生分析判断能力,明确弱电解质电离特点及影响反应速率因素是解本题关键,注意:化学反应速率与离子浓度成正比,与电解质强弱无关,题目难度不大.


科目:高中化学 来源: 题型:实验题
| 实验 编号 | 温度 | 初始pH | 0.1mol/L 草酸溶液/mL | 0.01mol/L KMnO4溶的 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
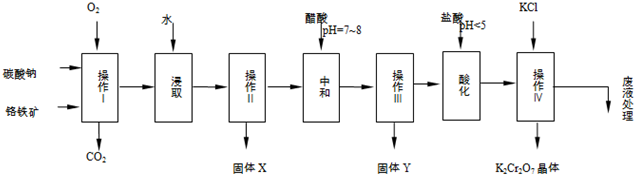
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
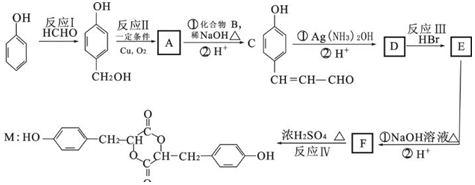
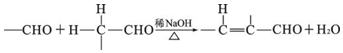
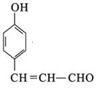 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O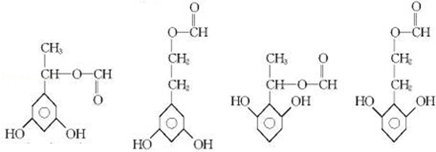 种.
种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未冷却就转移、定容 | B. | 容量瓶原有少量蒸馏水 | ||
| C. | 定容时俯视刻度线观察液面 | D. | 量筒取浓盐酸时,俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
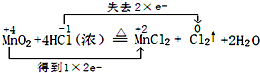 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com