
【题目】由铜片、锌片和200mL稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出2.24L(标准状况)气体时,H2SO4恰好完全消耗.求:
(1)反应中消耗的锌的质量是多少?(Zn:65)
(2)有多少个电子通过了导线?
【答案】
(1)解:该原电池中,锌电极上电极反应式为Zn﹣2e﹣=Zn2+,铜电极上电极反应式为2H++2e﹣=H2↑,则电池总反应式为Zn+2H+=H2↑+Zn2+,生成氢气的物质的量为: ![]() =0.1mol,
=0.1mol,
由方程式可知,n(Zn)=n(H2)=0.1mol,故消耗Zn的质量为0.1mol×65g/mol=6.5g,
答:反应中消耗的锌的质量是6.5g
(2)解:转移电子数目为0.1mol×2×[0﹣(﹣1)]×6.02×1023mol﹣1=6.02×1022,答:有6.02×1022个电子通过了导线
【解析】该原电池中,锌电极上电极反应式为Zn﹣2e﹣=Zn2+ , 铜电极上电极反应式为2H++2e﹣=H2↑,则电池总反应式为Zn+2H+=H2↑+Zn2+ , (1)根据反电池总反应式计算Zn的质量;(2)根据H元素化合价变化计算转移电子;


科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
【实验Ⅰ】制取NaNO2
该小组先查阅资料知:①2NO+Na2O2 →2NaNO2;2NO2+Na2O2 →2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如下图(夹持装置略去):

(1)装置A中用于盛放稀HNO3溶液的仪器名称为________;写出装置A中发生主要反应的离子方程式:__________。
(2)装置D的作用是____________;
(3)如果没有B装置,C中发生的副反应的化学方程式①_______ 、②______。
(4)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。下列哪种方案可以提高NaNO2纯度________。
A.将B中的药品换为碱石灰 B.将稀硝酸换为浓硝酸
C.实验开始前通一段时间CO2 D.在A、B之间增加盛有水的洗气瓶
【实验Ⅱ】测定NaNO2样品中NaNO3的含量
步骤:(1)配置KMnO4标准溶液并酸化,酸化KMnO4的酸应选择________(填化学式)
(2)已知在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定亚硝酸钠的含量,称取4.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,消耗KMnO4 20.00mL,酸性KMnO4的作用是______和_______,计算所得固体中亚硝酸钠的质量分数__________。(结果保留一位小数)
【扩展实验Ⅲ】该学习小组为再了解氧族元素的一些典型化合物的性质,进行了如下实验探究。
经查知:硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分 可能是SO2、SO3和O2中的一种、两种或三种。他们通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如图所示:

(1)提出猜想
①所得气体的成分可能只含________一种;
②所得气体的成分可能含有________两种;
③所得气体的成分可能含有SO2、SO3和O2三种。
(2)实验探究
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
①请你组装探究实验的装置,按从左至右的方向,则仪器接口的连接顺序为______ (填序号)。
②由于加热时的温度不同,实验结束后测得相关数据也不同。数据如下:
实验 | 称取CuSO4的质量/g | 仪器C 增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
第一组 | 6.4 | 2.88 | 224 |
第二组 | 6.4 | 2.56 | 448 |
请通过计算,推断出第一组和第二组的实验条件下CuSO4分解反应的化学方程式:
第一组_________________; 第二组_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中,能大量共存的是( )
A. c(H+)=0.1 mol·L-1的溶液:Na+、NH、SO![]() 、S2O
、S2O![]()
B. 与铝粉反应放出H2的无色溶液:NO、Al3+、Na+、SO![]()
C. 中性溶液:Fe3+、Al3+、NO、SO![]()
D. 常温下c(H+)/c(OH-)=1×10-12的溶液:K+、AlO、CO![]() 、Na+
、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸
B. 该混合溶液pH=7.0
C. 该混合溶液中:c(A-)+c(Y)=c(Na+)
D. 图中X表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的元素,只有E不属于短周期,相关信息如下表:
元素 | A | B | C | D | E |
相关 | A元素原子核外有3个电子层,最外层有3个电子. | 与元素C可形成离子个数比 | C元素的原子K、L层电子数之和比L、M层电子数之和多1个电子 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属, |
回答下列问题(化学用语中的元素用相应的元素符号表示):
(1)E在元素周期表中的位置是 .
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度>(氢化物的化学式).
(3)写出B、C形成化合物的电子式:、 .
(4)鉴别D的两种氧化物的一种试剂是;检验E3+的方法是 .
(5)写出A、C的最高价氧化物的水化物反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应中能量变化的说法错误的是( ) 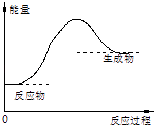
A.如图所示的反应为吸热反应
B.化学反应中有物质变化也有能量变化
C.需要加热才有发生的反应一定是吸热反应
D.化学键断裂吸收能量,化学键生成放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如下图所示。则下列离子组在对应的溶液中,一定能大量共存的是( )
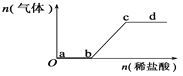
A. a点对应的溶液中:Na+、OH-、SO![]() 、NO
、NO![]()
B. b点对应的溶液中:Al3+、Fe3+、MnO![]() 、Cl-
、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO![]() 、Cl-
、Cl-
D. d点对应的溶液中:F-、NO![]() 、Fe3+、Ag+
、Fe3+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是
A.通常状况下,NA个二氧化碳分子占有的体积为22.4L
B.18g水所含的分子数为NA
C.标准状况下,22.4L氢气所含的原子数目为NA
D.NA个硫酸分子共有6mol原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com