
【题目】设NA为阿伏伽德罗常数的值,下列有关说法不正确的是
A.常温下,48gO3含有的氧原子数3NA
B.标准状况下,33.6LCO中含有的原子数是3NA
C.0.5mol·L-1CaCl3溶液中含Cl-数目为NA
D.17gNH3所含的电子数为10NA
科目:高中化学 来源: 题型:
【题目】下图是a、b两种固体物质的溶解度曲线,下列说法中,正确的是( )

A.a的溶解度大于b的溶解度
B.在t℃时,a、b的饱和溶液中溶质的物质的量浓度相同
C.当a中含有少量b时,可以用冷却结晶法提纯a
D.在t℃时,将a、b的饱和溶液升温后,溶质的质量分数:a﹥b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为( )
A. 量筒 B. 容量瓶 C. 滴定管 D. 以上均不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
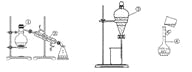
(1)写出下列仪器的名称:①_______________:②___________
(2)仪器①~④中,使用时必须检查是否漏水的有______(填序号)。
(3)若利用装置Ⅰ分离两种液态有机物乙二醇和丙三醇组成的混合物,还缺少的仪器有____,将仪器指补充完整后进行实验,②的进水口是_(填“f”或“g”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的量如下表。

向FeCl3、Al2(SO4)3的混合溶液中逐有加入Ba(OH)2溶液,形成沉淀的情况如下图所示.以下推断错误的是

A.AB段可能发生的反应:2Ba2++3OH-+2SO42-+Al3+=2BaSO4↓+Al(OH)3↓
B.C点对应的沉淀:Fe(OH)3和BaSO4
C.OA段可能发生的反应:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.据图计算原溶液中:c(Cl-)=c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料与人类生活密切相关。下列物品与对应的材料相匹配的是( )
A.光导纤维——硅酸盐材料
B.透明饮料瓶——合金材料
C.纯棉织物——合成纤维材料
D.橡胶轮胎——有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合题:
氢气是清洁的能源,也是重要的化工原料,根据以下三种制氢方法。完成下列问题:
(1)方法一:H2S热分解法,反应式为:2H2S(g)![]() 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见下图,图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
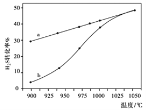
①△H0,(“>”、“<”或“=”)。
②若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=
(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)△H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=kJ/mol;
CaCO3(s)+2H2(g)的△H=kJ/mol;
若K1、K2、K3分别为反应I、Ⅱ、Ⅲ的平衡常数,该平衡常数K=(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是。(填字母)
A.降低体系的温度
B.压缩容器的体积
C.增加CaO的量
D.选用适当的催化剂
(3)方法三:利用甲醇可以与水蒸气反应制取H2,反应方程式如下:
CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+49.4kJ/mol
CO2(g)+3H2(g)△H=+49.4kJ/mol
一定温度下,向容积为2L的密闭恒容容器中充入1molCH3OH(g)和3molH2O(g),达到平衡状态时,吸收热量19.76kJ。则
①达平衡时混合气体的压强是反应前的倍。
②此温度下的该反应的平衡常数是(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值。下列说法正确的有( )个
①.标准状况下,0. 1 mol Cl2溶于水,转移的电子数目为0.1NA
②.常温常压下,等物质的量的 N2与CO气体含有的原子数目均为NA
③.标准状况下,6. 72 L NO2与水充分反应转移的电子数目为0. 1NA
④.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
⑤.将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
⑥.1 mol Fel2与足量氯气反应时转移的电子数为2NA
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com