
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极. 
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为极;
②电极b上发生的电极反应为;
③列式计算电极b上生成的气体在标准状况下的体积:
④电极c的质量变化是g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液;
乙溶液;
丙溶液;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? .
【答案】
(1)正;4OH﹣﹣4e﹣=2H2O+O2↑;2.8L;16;甲增大,因为相当于电解水;乙减小,OH﹣放电,H+增多;丙不变,相当于电解水
(2)可以,铜全部析出,可以继续电解H2SO4 , 有电解液即可电解
【解析】解:(1)①乙杯中c质量增加,说明Cu沉积在c电极上,电子是从b﹣c移动,M是负极,N为正极,所以答案是:正极;②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH﹣放电,即4OH﹣﹣4e﹣=2H2O+O2↑,所以答案是:4OH﹣﹣4e﹣=2H2O+O2↑;③丙中为K2SO4 , 相当于电解水,设电解的水的质量为x.由电解前后溶质质量相等有,100×10%=(100﹣x)×10.47%,得x=4.5g,故为0.25mol.由方程式2H2+O2═2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L,所以答案是:答案2.8L; ④整个电路是串联的,所以每个烧杯中的电极上转移电子数是相等的,根据电极反应:Cu2++2e﹣=Cu,可知转移0.5mol电子生成的m(Cu)= ![]() ×64=16g,所以答案是:16;⑤甲中相当于电解水,故NaOH的浓度增大,pH变大.乙中阴极为Cu2+放电,阳极为OH﹣放电,电解方程式为:2CuSO4+2H2O
×64=16g,所以答案是:16;⑤甲中相当于电解水,故NaOH的浓度增大,pH变大.乙中阴极为Cu2+放电,阳极为OH﹣放电,电解方程式为:2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4 , 所以H+增多,故pH减小.丙中为电解水,对于K2SO4而言,其pH几乎不变.所以答案是:甲增大,因为相当于电解水;乙减小,OH﹣放电,H+增多.丙不变,相当于电解水;(2)当铜全部析出时,溶液中仍有电解质硫酸,可以继续电解,所以答案是:可以; 铜全部析出,可以继续电解H2SO4 , 有电解液即可电解.
2Cu+O2↑+2H2SO4 , 所以H+增多,故pH减小.丙中为电解水,对于K2SO4而言,其pH几乎不变.所以答案是:甲增大,因为相当于电解水;乙减小,OH﹣放电,H+增多.丙不变,相当于电解水;(2)当铜全部析出时,溶液中仍有电解质硫酸,可以继续电解,所以答案是:可以; 铜全部析出,可以继续电解H2SO4 , 有电解液即可电解.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】生活中常见的荧光棒的发光原理可用下式表示: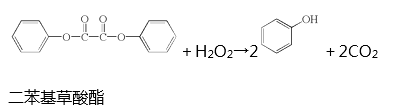
上述反应产生的能量传递给荧光染料分子后,使染料分子释放出荧光。下列说法正确的是( )
A.上述反应是酯的水解反应
B.荧光棒发光过程涉及化学能到光能的转化
C.二苯基草酸酯苯环上的一氯代物共有4种
D.二苯基草酸酯与草酸( ![]() )互为同系物
)互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成共价化合物XH3、H2Z和HW;Y与氧元素可形成离子化合物Y2O和Y2O2。
(1)Y2Z的电子式是 ________
(2)实验室可用如图所示装置制备并收集XH3(缺少收集装置,夹持固定装置略去)。

①图中方框内应选用连接_____烧瓶收集XH3(填“A或B”)。
②实验室制法中大试管中的试剂一般选用(填写化学式)_________________。烧杯中溶液由无色变为红色,其原因是(用电离方程式表示):___________________________________
③XH3是工业上氧化法制硝酸的重要基础原料,制备过程中该物质发生的化学反应方程式为__________________________。
(3)磷在W2中燃烧可生成两种产物,其中一种产物甲,分子中各原子最外层不全是8电子结构,甲的化学式是_________。 XH3和HW两种化合物能反应生成离子化合物乙,n mol甲与n mol乙在一定条件下反应,生成4n mol HW和另一化合物,该化合物蒸气的密度是相同状况下氢气密度的174倍,其化学式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向0.01 mol·L1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如右图所示。下列分析正确的是( )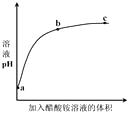
A.a点,pH = 2
B.b点,c(CH3COO-) > c(NH4+)
C.c点,pH可能大于7
D.ac段,溶液pH增大是CH3COOH ![]() H+ + CH3COO-逆向移动的结果
H+ + CH3COO-逆向移动的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行下列实验:( )
操作 | 现象 |
|
|
下列说法不合理的是
A.生铁片发生吸氧腐蚀
B.中心区:Fe–2e-=Fe2+
C.边缘处:O2+2H2O+4e-=4OH-
D.交界处:4Fe2++O2+10H2O=4Fe(OH)3+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列一定量的各物质所含原子个数按由大到小的顺序排列的是
①0.5 mol氨气②标准状况下22.4 L氦气③4 ℃时9 mL水④0.2 mol磷酸(H3PO4)
A. ①④③② B. ④③②①
C. ②③④① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18.4molL﹣1的浓H2SO4配制100mL浓度为1molL﹣1的稀H2SO4,其操作可分为以下各步:
A.用量筒量取5.4ml浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒搅拌;
B.用约30mL蒸馏水,分成3次洗涤烧杯和玻棒,将每次洗涤液都注入容量瓶中;
C.将稀释后的H2SO4小心转移到100mL容量瓶里;
D.检查100mL容量瓶口部是否会发生滴漏;
E.加蒸馏水至容量瓶中液面接近刻度2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴加蒸馏水至液面最低点和刻度线相平,试填空
①正确的操作顺序为(用字母填写)________________________.
②进行A步操作时,应选择下列量器___(填序号).
a.10ml量筒 b.50ml量筒 c.100ml量筒
如果对装有浓H2SO4的量筒读数如下图所示,配制的稀H2SO4的浓度将__(偏高、偏低、无影响)
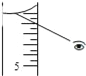
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com