


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
| A、用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
| B、将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
| C、向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7 Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液Ca2++HCO3-+OH-=CaCO3↓++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
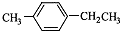 )是一种重要的有机原料,用该物质可合成其他物质.
)是一种重要的有机原料,用该物质可合成其他物质.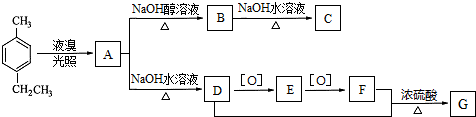
查看答案和解析>>
科目:高中化学 来源: 题型:
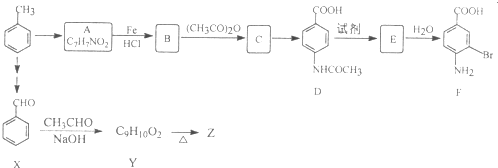
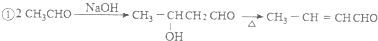
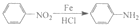 苯胺中氨基易被氧化.
苯胺中氨基易被氧化.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ①溶解 |
| ②加入NaOH |
| ③加入() |
| ④加入() |
| ⑤过滤 |
| ⑥加入() |
| ⑦() |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com