
| ①溶解 |
| ②加入NaOH |
| ③加入() |
| ④加入() |
| ⑤过滤 |
| ⑥加入() |
| ⑦() |


科目:高中化学 来源: 题型:
| A、25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、标准状况下,1molCF4中含有的电子对数目为4.0NA |
| C、1L 0.5mol?L-1 的H2SO3溶液中含有的H+数目为NA |
| D、1molN2与3molH2混合充分反应后生成NH3分子数小于2.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
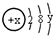 ,试回答:
,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
2 1 |
3 1 |
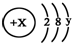 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| b | |||||||||||||||||
| e | g | h | |||||||||||||||
| a | c | f | i | j | |||||||||||||
| d | |||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com