
1 1 |
2 1 |
3 1 |
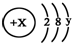 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题:| 16×3 |
| 16×3+X |


科目:高中化学 来源: 题型:
| A、氯气的水溶液能导电,所以氯气属于电解质 |
| B、稀H2SO4溶液能导电,稀H2SO4是电解质 |
| C、由于NH3?H2O溶于水,而Ca(OH)2微溶于水,所以NH3?H2O是强电解质,Ca(OH)2是弱电解质 |
| D、硫酸钡难溶于水,但硫酸钡属于强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
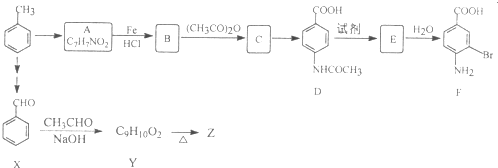
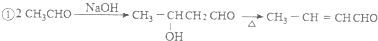
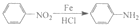 苯胺中氨基易被氧化.
苯胺中氨基易被氧化.查看答案和解析>>
科目:高中化学 来源: 题型:
| ①溶解 |
| ②加入NaOH |
| ③加入() |
| ④加入() |
| ⑤过滤 |
| ⑥加入() |
| ⑦() |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、①②④ |
| C、③④ | D、②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com