
【题目】含 卤 族 元 素 的 化 合 物 在 科 研 和 生 产 中 有 许 多 重 要 用 途 。 如 : 2 m o l S b ( C H 3 ) 3 、 2 m o lSb(CH3)2Br 和 2molSb(CH3)Br2 进行重组反应可生成空间位阻最小的离子化合物:[Sb2(CH3)5]2 [Sb2(CH3)2Br6],已知 Sb 与 N 同主族。请回答:
(1) 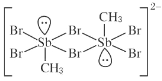 中,H、C、Br 的电负性由小到大的顺序为_____,溴原子的价电子排布式 为_____。
中,H、C、Br 的电负性由小到大的顺序为_____,溴原子的价电子排布式 为_____。
(2)[Sb2(CH3)5] +的结构式为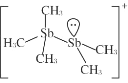 ,Sb 原子的杂化轨道类型为_____。写出一种与CH3 -互为等电子体的分子_____。
,Sb 原子的杂化轨道类型为_____。写出一种与CH3 -互为等电子体的分子_____。
(3)X 射线衍射测定等发现,I3AsF6 中存在 I3+ 离子。I3+ 离子的几何构型为_____。
(4)一定条件下 SbCl3 与 GaCl3 以物质的量之比为 l:l 混合得到一种固态离子化合物,其结构组成可能 为:(a) [GaCl2+ ][SbCl4- ]或(b) [SbCl2+ ][GaCl4- ],该离子化合物最可能的结构组成为_____ (填“a”或“b”),理由是_____。
(5)固态 PCl5 结构中存在 PCl4+ 和 PCl6 -两种离子,其晶胞如图所示。
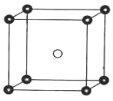
已知晶胞的边长为 a pm ,阿伏加德罗常数值用 NA表示。则 PCl4+ 和 PCl6 - 之间的最短距离为_____pm,固态 PCl5 的密度为_____gcm-3。
【答案】H<C<Br 4s24p5 sp3 杂化 NH3 V 形 b GaCl3 分子中,Ga 原子周围价层电子对数为 3,是电子对的接受体,更容易与 Cl—上的孤电子对结合,形成配位键,构成[GaCl4-]离子,因此可能结构应是[SbCl2+][GaCl4-] ![]() a
a ![]()
【解析】
(1)元素的非金属性越强,电负性数值越大,H、C、Br的电负性由大到小的顺序为Br>C>H;溴为35号元素,其价电子排布式为:4s24p5,故答案为:H<C<Br、4s24p5;
(2)根据[Sb2(CH3)5] +的结构式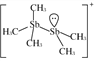 可知,Sb原子的价层电子对数均=4,采用sp3杂化;CH3-中含有4个原子、10个电子,与CH3-互为等电子体的分子NH3,故答案为:sp3杂化;NH3;
可知,Sb原子的价层电子对数均=4,采用sp3杂化;CH3-中含有4个原子、10个电子,与CH3-互为等电子体的分子NH3,故答案为:sp3杂化;NH3;
(3)I3+中心I原子外层6个电子,其中两个分别和两端I原子生成共价键,剩余4个电子是两对孤对电子。于是中心I原子有4对价电子对,其中两对成键电子对,两对孤对电子对,四对电子对是sp3杂化,空间构型是V型;故答案为:V形;
(4)[SbCl2+]中Sb的价层电子对数=2+![]() (5-1+2×1)=3,[GaCl2+]中Ga的价层电子对数=2+
(5-1+2×1)=3,[GaCl2+]中Ga的价层电子对数=2+![]() (3-1+2×1)=2;[SbCl2+][GaCl4-]阳离子中的Sb呈+3价符合N族元素价键规律,阴离子中的Ga有三个电子与三个Cl原子形成三个共用电子对后还有一个空P轨道,可以结合一个氯离子形成8电子稳定结构;[GaCl2+][SbCl4-]中阳离子镓呈正三价符合第IIIA族元素价键规律,但是阴离子中Sb原子周围却有9个电子,比8电子稳定结构多一个电子,故不稳定,因此结构应是[SbCl2+][GaCl4-],故答案为:b;GaCl3分子中,Ga原子周围价层电子对数为3,是电子对的接受体,更容易与Cl—上的孤电子对结合,形成配位键,构成[GaCl4—]离子,因此可能结构应是[SbCl2+][GaCl4—];
(3-1+2×1)=2;[SbCl2+][GaCl4-]阳离子中的Sb呈+3价符合N族元素价键规律,阴离子中的Ga有三个电子与三个Cl原子形成三个共用电子对后还有一个空P轨道,可以结合一个氯离子形成8电子稳定结构;[GaCl2+][SbCl4-]中阳离子镓呈正三价符合第IIIA族元素价键规律,但是阴离子中Sb原子周围却有9个电子,比8电子稳定结构多一个电子,故不稳定,因此结构应是[SbCl2+][GaCl4-],故答案为:b;GaCl3分子中,Ga原子周围价层电子对数为3,是电子对的接受体,更容易与Cl—上的孤电子对结合,形成配位键,构成[GaCl4—]离子,因此可能结构应是[SbCl2+][GaCl4—];
(5)根据图示,则PCl4+和PCl6-之间的最短距离为体对角线长度的一半=![]() a pm;
a pm;
由晶胞结构可知,PCl4+和PCl6-的数目分别为8×![]() =1和1,则晶胞质量为
=1和1,则晶胞质量为![]() g,晶胞边长为a pm,则晶胞密度
g,晶胞边长为a pm,则晶胞密度![]() g÷(a×10-10cm)3=
g÷(a×10-10cm)3=![]() g/cm3,故答案为:
g/cm3,故答案为: ![]() a;
a; ![]() 。
。


 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液pH、n[Al(OH)3]随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法不正确的是
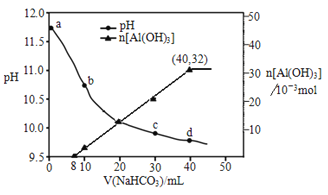
A. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
B. b 点与c点溶液所含微粒种类相同
C. a 点溶液中大量存在的离子是Na+、AlO2-、OH-
D. NaHCO3溶液的物质的量浓度为0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g) △H= -1077kJmol-1
已知相关反应的化学键键能数据如下表所示:
化学键 | N-H | N-N | N≡N | O-H |
E/(kJmol-1) | 390 | 190 | 946 | 460 |
则使1mol N2O4(g)分子中化学键完全断裂时需要吸收的能量是___________。
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。

①由图推测该反应的△H ___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强po为108 kPa,则该温度下反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。

(3)电解NO2制备NH4NO3,其工作原理如图所示。

①阳极的电极反应式为________________________________________。
②为使电解产物全部转化为NH4NO3,需补充某种化合物A,则A的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,针对图像下列分析不正确的是
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,针对图像下列分析不正确的是
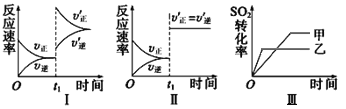
A.图Ⅰ研究的是t1时刻增大压强(缩小体积)对反应速率的影响
B.图Ⅱ研究的是t1时刻通入氦气(保持恒容)对反应速率的影响
C.图Ⅱ研究的是t1时刻加入正催化剂对反应速率的影响
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含锰矿石的主要成分是 MnO2,还含 CaO、Al2O3、FeS 杂质,由此矿石生产 MnCO3 的工艺流 程如图所示:
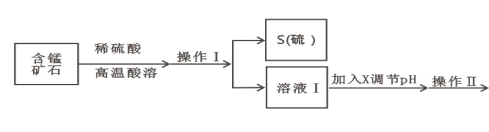
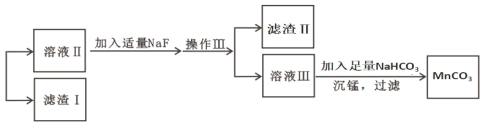
已知:①相关金属离子生成氢氧化物沉淀的 pH 如表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.8 | 4.7 |
Mn(OH)2 | 8.8 | 10.4 |
Ca(OH)2 | 12 | ─ |
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
(1)酸溶时,是否能将稀硫酸换成浓盐酸_____(填“ 是” 或“ 否” );操作 I 的名称 为_____。
(2)取溶液Ⅰ加入 KSCN 溶液,溶液呈血红色,试写出酸溶过程中 MnO2 与 FeS 发生反应的离子方程 式:_____。
(3)调节溶液Ⅰ的 pH 时,pH 的范围为_____;所用的物质 X 最好是_____(填字母)。
A.盐酸 B.NaOH 溶液 C.氨水 D.MnCO3 固体
(4)滤渣Ⅰ为_____,滤渣Ⅱ为_____。(填化学式)
(5)沉锰的化学方程式为_____。
(6)沉锰后过滤得到固体 MnCO3,设计实验方案验证 MnCO3 固体是否洗涤干净:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为 101℃,易溶于水,受热易脱水、升华,170℃以上分解。 常温下它的电离常数 K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)查阅资料知:草酸晶体 175℃分解成 CO2、CO、H2O,请写出草酸晶体分解的化学反应方程 式:_____。
(2)请用下列的装置(图中加热装置已略去)分解草酸晶体以制备少量 CO 气体,最佳的连接顺序 为:_____。(填字母序号)
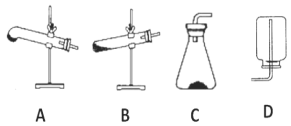
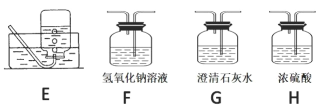
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____(填序号)。
A.室温下,测 0.1mol/L 的 H2C2O4 溶液与 H2SO4 溶液的 pH,硫酸溶液的 pH 比草酸的小;
B.室温下,取 pH=3 的 H2C2O4 溶液稀释 100 倍后,测其 pH<5;
C.标况下,取 0.10mol/L 的 H2C2O4 溶液 100mL 与足量锌粉反应,收集到 H2 体积为 224mL。
(4)现需要配制 900mL1mol/L 的草酸溶液。
①需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、________ 、_________ (填仪 器名称)。
②下列操作会使所配溶液浓度偏低的是_____。(填字母)
A.称量时用了生锈的砝码
B.容量瓶未干燥即用来配制溶液
C.H2C2O4·2H2O 晶体失去了部分结晶水
D.定容时,仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(5)用草酸滴定 KMnO4 溶液的方法可测定 KMnO4 粗品的纯度(质量分数)。
①滴定过程中反应的离子方程式为_____。
②量取 KMnO4 样品溶液应选用_________ (填“酸式”或“碱式”)滴定管;若量取 KMnO4 样品溶液的 滴定管用蒸馏水洗净后未润洗,则最终的测定结果将_______(填“偏大”、“偏小”或“不变”)。
③现取 KMnO4 粗品 10g,配成 100mL 溶液,取 25.0 mL 用(4)中配制的草酸溶液滴定,并进行 3 次 平行实验,所用的草酸溶液的体积分别为 23.00 mL、20.02 mL、19.98 mL,请问 KMnO4 粗品的质量分数 为_____________。(已知:KMnO4 的摩尔质量为 158g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是
|
|
|
|
A.配制 0.10 mol·L-1NaOH溶液 | B.苯萃取碘水中I2,分出水层后的操作 | C.除去CO中的CO2 | D.记录滴定终点读数为12.20mL |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列问题:
(1)CO2的电子式是 。
(2)△H1= kJ/mol,①反应正向的熵变△S 0(填>、<或=)。
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图,下列说法正确的是__________(填序号)
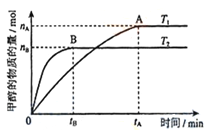
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tA mol/(L·min)
②当v(CH3OH) = v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;T1温度,反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数数值为__________。
CO2(g)+3H2(g)的平衡常数数值为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子。该小组同学取100 mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1 mol·L-1的硝酸,实验过程中沉淀质量的变化情况如图所示:
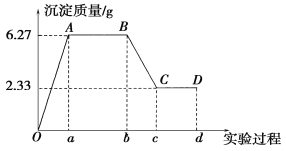
注明:Ob段表示滴加硝酸钡溶液;bd段表示滴加稀硝酸
(1)水样中一定含有的阴离子是________,其物质的量浓度之比为________。
(2)写出BC段所表示反应的离子方程式:__________________________________________。
(3)由B点到C点变化过程中消耗硝酸的体积为________。
(4)试根据实验结果推断K+是否存在?________(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是__________________。(若K+不存在,则不必回答该问)
(5)设计简单实验验证原水样中可能存在的离子:_____________________。(写出实验步骤、现象和结论)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com