
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g) △H= -1077kJmol-1
已知相关反应的化学键键能数据如下表所示:
化学键 | N-H | N-N | N≡N | O-H |
E/(kJmol-1) | 390 | 190 | 946 | 460 |
则使1mol N2O4(g)分子中化学键完全断裂时需要吸收的能量是___________。
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。

①由图推测该反应的△H ___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强po为108 kPa,则该温度下反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。

(3)电解NO2制备NH4NO3,其工作原理如图所示。

①阳极的电极反应式为________________________________________。
②为使电解产物全部转化为NH4NO3,需补充某种化合物A,则A的化学式为_________。
【答案】1941 kJ >温度升高,α(N2O4)增加,说明平衡右移。该反应为吸热反应,△H>0115.2KPa![]() B点与D点NO2-e-+H2O=NO3-+2H+NH3
B点与D点NO2-e-+H2O=NO3-+2H+NH3
【解析】
根据反应的焓变=反应物总键能-生成物总键能计算。根据图像分析,随着温度升高,四氧化二氮的平衡转化率增大,说明升高温度有利于反应正向进行,据此判断焓变。根据反应方程式计算平衡时体系中的四氧化二氮和二氧化氮的分压,代入平衡常数表达式计算分压平衡常数即可。电解池阳极发生氧化反应,根据原理分析,二氧化氮在阳极变为硝酸根离子,阴极为二氧化氮变为铵根离子,根据电子守恒分析硝酸根离子和铵根离子的物质的量的关系,并分析使二氧化氮电解全部转化为硝酸铵需要将剩余的氢离子转化为铵根离子,据此分析A物质。
(1) 假设1mol N2O4(g)分子中化学键完全断裂时需要吸收的能量为xkJ,△H =2×(190+390×4)+x-946×3-460×8=-1077,计算x=1941 kJ; (2) ①根据图像分析,随着温度升高,α(N2O4)增加,说明平衡右移。该反应为吸热反应,△H>0 ;②四氧化二氮与二氧化氮之间存在反应,a点起始时四氧化二氮的压强为108kPa,四氧化二氮的平衡转化率为40%,则平衡时p(N2O4)=po (1-40%),p(NO2)= po ×40%×2,所以反应的分压平衡常数为![]() 115.2KPa; ③当达到平衡时满足正逆反应速率相等,即消耗速率2v( N2O4)= v(NO2),又有v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),则k1、k2与平衡常数Kp的关系为Kp=
115.2KPa; ③当达到平衡时满足正逆反应速率相等,即消耗速率2v( N2O4)= v(NO2),又有v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),则k1、k2与平衡常数Kp的关系为Kp= ![]() 。根据2v( N2O4)= v(NO2),则可以表示化学平衡的点为B点与D点。 (3) ①电解池阳极发生氧化反应,根据原理图分析,二氧化氮在阳极失去电子转化为硝酸根离子,则阳极的电极反应为 NO2-e-+H2O=NO3-+2H+;②阴极反应为二氧化氮变成铵根离子,电极反应为NO2+7e-+8H+ =NH4++2H2O,产生多余的氢离子,为了使二氧化氮电解全部转化为硝酸铵,则需要反应掉H+产生铵根离子,所以加入的A物质为NH3。
。根据2v( N2O4)= v(NO2),则可以表示化学平衡的点为B点与D点。 (3) ①电解池阳极发生氧化反应,根据原理图分析,二氧化氮在阳极失去电子转化为硝酸根离子,则阳极的电极反应为 NO2-e-+H2O=NO3-+2H+;②阴极反应为二氧化氮变成铵根离子,电极反应为NO2+7e-+8H+ =NH4++2H2O,产生多余的氢离子,为了使二氧化氮电解全部转化为硝酸铵,则需要反应掉H+产生铵根离子,所以加入的A物质为NH3。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】图甲为在铜棒上电镀银的装置,图乙是在图甲装置中央放置质量相等的两个银圈,用绳子系住(绳子为绝缘体),一段时间后,两装置中铜极质量均增重1.08g。下列说法不正确的是
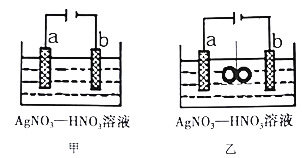
A. 电极a为纯银
B. 图甲:若b极有标况下112mL红棕色气体生成,则电子有效利用率为50%
C. 图乙:若乙池中无气体生成,则绳子两端银圈质量之差为2.16g
D. 处理银器表面的黑班(Ag2S),将银器置于盛有食盐水的铝制容器里并与铝接触,则Ag2S可以转化为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学一选修5:有机化学基础)有机物H是一种中枢神经兴奋剂,其合成路线如下图所示。
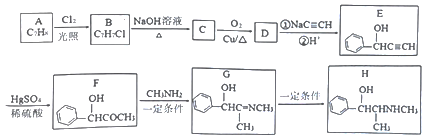
请回答下列问题:
(1)A的化学名称为______,C的结构简式为________。
(2)E中官能团的名称为______。B→C、G→H的反应类型分别为____、______。
(3)D分子中最多有___个原子共平面。
(4)F→G历经两步反应,第一步反应的化学方程式为_______。
(5)同时满足下列条件的F的同分异构体有___种(不考虑立体异构)。
①能发生银镜反应; ②能与氯化铁溶液反应; ③分子中只有1个甲基。
其中核磁共振氢谱有6组峰的结构简式为___________。
(6)最近网上流传,某明星的天价童颜针,其主要成分为聚乳酸,结构简式为 ,它是具有填充、紧致、提拉多重效果的微整形新武器,且具有生理兼容性与可降解性,比传统的硅胶填充整容要先进。参照上述合成路线,以丙烯为原料制备
,它是具有填充、紧致、提拉多重效果的微整形新武器,且具有生理兼容性与可降解性,比传统的硅胶填充整容要先进。参照上述合成路线,以丙烯为原料制备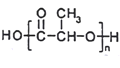 的合成路线流程图(无机试剂任选)____________________。
的合成路线流程图(无机试剂任选)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的NaOH和HCl物质的量之比为( )
A. 3: 1 B. 2:1 C. 1:1 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnSO4·7H2O和CuSO4·5H2O的部分实验步骤如下:
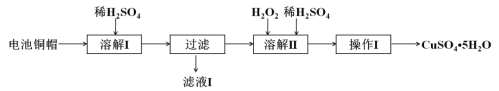
(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是___________、____________。
(2) 从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为__________、__________、过滤、冰水洗涤、低温干燥。
(3)在“溶解II”步骤中,发生反应的离子方程式为____________________________。
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol·L-1Na2S2O3溶液至刚好完全反应,消耗Na2S2O3溶液25.00mL。已知:2Cu2++4I-===2CuI(白色)↓+I2, 2S2O32-+I2===2I-+S4O62- 请依据实验数据计算样品中CuSO4·5H2O的质量分数(写出计算过程)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含 卤 族 元 素 的 化 合 物 在 科 研 和 生 产 中 有 许 多 重 要 用 途 。 如 : 2 m o l S b ( C H 3 ) 3 、 2 m o lSb(CH3)2Br 和 2molSb(CH3)Br2 进行重组反应可生成空间位阻最小的离子化合物:[Sb2(CH3)5]2 [Sb2(CH3)2Br6],已知 Sb 与 N 同主族。请回答:
(1) 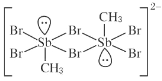 中,H、C、Br 的电负性由小到大的顺序为_____,溴原子的价电子排布式 为_____。
中,H、C、Br 的电负性由小到大的顺序为_____,溴原子的价电子排布式 为_____。
(2)[Sb2(CH3)5] +的结构式为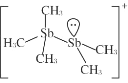 ,Sb 原子的杂化轨道类型为_____。写出一种与CH3 -互为等电子体的分子_____。
,Sb 原子的杂化轨道类型为_____。写出一种与CH3 -互为等电子体的分子_____。
(3)X 射线衍射测定等发现,I3AsF6 中存在 I3+ 离子。I3+ 离子的几何构型为_____。
(4)一定条件下 SbCl3 与 GaCl3 以物质的量之比为 l:l 混合得到一种固态离子化合物,其结构组成可能 为:(a) [GaCl2+ ][SbCl4- ]或(b) [SbCl2+ ][GaCl4- ],该离子化合物最可能的结构组成为_____ (填“a”或“b”),理由是_____。
(5)固态 PCl5 结构中存在 PCl4+ 和 PCl6 -两种离子,其晶胞如图所示。
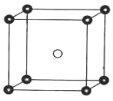
已知晶胞的边长为 a pm ,阿伏加德罗常数值用 NA表示。则 PCl4+ 和 PCl6 - 之间的最短距离为_____pm,固态 PCl5 的密度为_____gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的2L密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g),达到平衡时,各物质的平衡浓度为:c(X)=0.8mol/L;c(Y)=0.1mol/L;c (Z)=1.6mol/L。若用a、b、c分别表示X、Y、Z的起始的物质的量,回答下列问题:
2Z(g),达到平衡时,各物质的平衡浓度为:c(X)=0.8mol/L;c(Y)=0.1mol/L;c (Z)=1.6mol/L。若用a、b、c分别表示X、Y、Z的起始的物质的量,回答下列问题:
(1)若在恒温恒容条件下进行反应X(g)+Y(g)![]() 2Z(g),可判断该反应达到化学平衡状态的是_____
2Z(g),可判断该反应达到化学平衡状态的是_____
A.单位时间内生成n molX的同时生成2nmolZ
B.密闭容器中密度不再改变的状态
C.用X、Y、Z的物质的量浓度变化表示反应速率的比为1∶1∶2的状态
D.反应容器中Y的物质的量分数不再改变的状态
E.密闭容器中压强不再改变的状态
F.混合气体的平均相对分子质量不再改变的状态
(2)a、b应满足的关系是_________。
(3)a的取值范围是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com