
【题目】图甲为在铜棒上电镀银的装置,图乙是在图甲装置中央放置质量相等的两个银圈,用绳子系住(绳子为绝缘体),一段时间后,两装置中铜极质量均增重1.08g。下列说法不正确的是
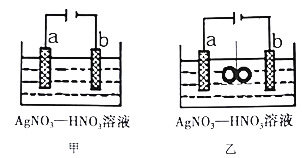
A. 电极a为纯银
B. 图甲:若b极有标况下112mL红棕色气体生成,则电子有效利用率为50%
C. 图乙:若乙池中无气体生成,则绳子两端银圈质量之差为2.16g
D. 处理银器表面的黑班(Ag2S),将银器置于盛有食盐水的铝制容器里并与铝接触,则Ag2S可以转化为Ag
【答案】B
【解析】分析: 在铜棒上电镀银,金属银做阳极,这里就是a极;b电极是阴极,发生还原反应,Ag++e-=Ag,若生成红棕色气体NO2,则又发生了NO3-+e-+2H+= NO2↑+H2O;为处理银器表面的黑斑,将银器置于铝制容器里的食盐水中并与铝接触,该装置构成原电池,食盐水作电解质溶液,加强溶液的导电性。以此解答。
A. 根据以上分析,图甲装置为在铜棒上电镀银,电极a做阳极,应为纯银,故A正确;
B. 铜极质量均增重1.08g,生成Ag的物质的量为:![]() =0.01mol,转移电子也是0.01mol,若b极有标况下112mL红棕色气体生成,即生成NO2的物质的量为:
=0.01mol,转移电子也是0.01mol,若b极有标况下112mL红棕色气体生成,即生成NO2的物质的量为:![]() =0.005mol,转移电子的物质的量为0.005mol,则电子有效利用率为
=0.005mol,转移电子的物质的量为0.005mol,则电子有效利用率为![]() ×100%=67%,故B不正确;
×100%=67%,故B不正确;
C. 图乙中左右各形成一个电镀池,若乙池中无气体生成,则绳子两端银圈左圈为左池的阴极,增重1.08g,右圈为右池的阳极,减重1.08g,两圈质量之差为2.16g,故C正确;
D. 处理银器表面的黑班(Ag2S),将银器置于盛有食盐水的铝制容器里并与铝接触,该装置构成原电池,Ag2S作正极被还原为Ag,故D正确。
综上所述,本题正确答案为B。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】半导体工业中,有一句行话:“从沙滩到用户”,即由SiO2制Si。制取过程中不涉及到的化学反应是
A. SiO2+2C![]() Si+2CO
Si+2CO
B. SiO2+2NaOH=Na2SiO3
C. Si+2Cl2![]() SiCl4
SiCl4
D. SiCl4+2H2![]() Si+4HCl
Si+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应设计了图示实验装置。

(1)在装药品开始实验前要进行的操作是_____
(2)a 克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A 无明显现象,其原因是常温下①_____;②_____。
(3)写出加热时 A 中碳与浓硫酸发生反应的化学方程式_____。
(4)B 中的现象是:_____;C 的作用是:_____。
(5)待 A 中不再逸出气体时,停止加热,拆下 E 并称重,E 增重 bg。则铁碳合金中铁的质量分数为_____(写含 a、b 的表达式)。
(6)经测定,(5)中测得结果偏小,原因可能是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL、2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
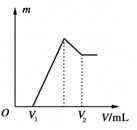
(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如上图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL、2 mol·L-1的H2SO4溶解此混合物后,再加入450 mL、1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 由C(石墨) = C(金刚石) △H=+1.9 kJ·mol-1可知,金刚石比石墨稳定
B. 在一定条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
C. 已知2C(s) + O2(g) = 2CO(g) △H=-221 kJ·mol-1,可知C的标准燃烧热为110.5 kJ·mol-1
D. 在一密闭容器中,9.6 g的硫粉与11.2 g的铁粉混合加热,充分反应,生成硫化亚铁17.6 g,放出19.12 kJ的热量,则Fe(s) + S(s) = FeS(s) △H= - 95.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 硅和C60的熔化克服相同类型作用力
B. 只有活泼金属元素与活泼非金属元素之间才能形成离子键
C. 等物质的量的CN-和N2含有的共用电子对数相等
D. 氯气与NaOH溶液反应的过程中,同时有离子键、极性键与非极性键的断裂和形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合动力汽车(HEV) 中使用了镍氢电池,其工作原理如图所示:其中M 为储氢合金,MH 为吸附了氢原子的储氢合金,KOH 溶液作电解液。关于镍氢电池,下列说法不正确的是

A. 充电时,阴极附近pH 降低
B. 电动机工作时溶液中OH-向甲移动
C. 放电时正极反应式为:NiOOH+H2O+e- =Ni(OH)2+OH-
D. 电极总反应式为:MH+NiOOH![]() M+Ni(OH)2
M+Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液pH、n[Al(OH)3]随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法不正确的是
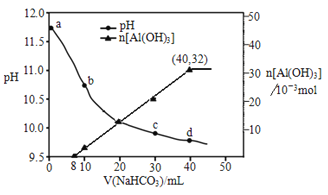
A. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
B. b 点与c点溶液所含微粒种类相同
C. a 点溶液中大量存在的离子是Na+、AlO2-、OH-
D. NaHCO3溶液的物质的量浓度为0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g) △H= -1077kJmol-1
已知相关反应的化学键键能数据如下表所示:
化学键 | N-H | N-N | N≡N | O-H |
E/(kJmol-1) | 390 | 190 | 946 | 460 |
则使1mol N2O4(g)分子中化学键完全断裂时需要吸收的能量是___________。
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。

①由图推测该反应的△H ___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强po为108 kPa,则该温度下反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。

(3)电解NO2制备NH4NO3,其工作原理如图所示。

①阳极的电极反应式为________________________________________。
②为使电解产物全部转化为NH4NO3,需补充某种化合物A,则A的化学式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com