
【题目】下列说法中正确的是
A. 硅和C60的熔化克服相同类型作用力
B. 只有活泼金属元素与活泼非金属元素之间才能形成离子键
C. 等物质的量的CN-和N2含有的共用电子对数相等
D. 氯气与NaOH溶液反应的过程中,同时有离子键、极性键与非极性键的断裂和形成
【答案】C
【解析】
A. 硅为原子晶体,熔化时破坏共价键,而C60为分子晶体,熔化时破坏的是范德华力,两者熔化克服的作用力类型不同,A项错误;
B. 离子化合物可能全部是由非金属元素组成的,如铵盐,B项错误;
C.CN中含有碳氮三键,带有1个单位负电荷,其电子式为:![]() ,1mol CN含有的共用电子对为3mol;氮气分子中存在氮氮三键,N2的电子式为:
,1mol CN含有的共用电子对为3mol;氮气分子中存在氮氮三键,N2的电子式为:![]() ,1mol N2含有的共用电子对也为3mol,则等物质的量的CN和N2含有的共用电子对数相等,C项正确;
,1mol N2含有的共用电子对也为3mol,则等物质的量的CN和N2含有的共用电子对数相等,C项正确;
D.氯气与NaOH溶液反应方程式为:2NaOH+Cl2═NaCl+NaClO+H2O,反应物中有离子键和共价键的断裂,生成物有离子键,极性键生成,没有非极性键的形成,D项错误;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】LED(Light EmittingDiode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )

A. 溶液中SO42-向铜片附近移动
B. 铜片上发生的反应为2H++2e-=H2↑
C. 导线中电子由锌片流向铜片
D. 如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是

A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界中不存在的P的一种同位素——![]() P,开创了人造核素的先河:
P,开创了人造核素的先河:![]() Al+
Al+![]() He→
He→![]() P+
P+![]() n。下列有关说法不正确的是( )
n。下列有关说法不正确的是( )
A. 该变化说明原子核在化学反应中也能发生变化
B. 该变化遵循质量守恒定律
C. ![]() n是一种电中性粒子
n是一种电中性粒子
D. 对于30P:原子序数=质子数=中子数=核外电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲为在铜棒上电镀银的装置,图乙是在图甲装置中央放置质量相等的两个银圈,用绳子系住(绳子为绝缘体),一段时间后,两装置中铜极质量均增重1.08g。下列说法不正确的是
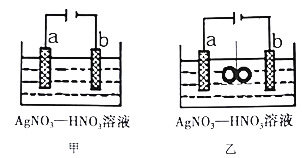
A. 电极a为纯银
B. 图甲:若b极有标况下112mL红棕色气体生成,则电子有效利用率为50%
C. 图乙:若乙池中无气体生成,则绳子两端银圈质量之差为2.16g
D. 处理银器表面的黑班(Ag2S),将银器置于盛有食盐水的铝制容器里并与铝接触,则Ag2S可以转化为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2 (g)+ O2(g) ![]() 2SO3(g) ΔH,有关数据如下:
2SO3(g) ΔH,有关数据如下:
T(℃) | 527 | 627 | 727 | 827 | 927 |
平衡常数K | 910 | 42 | 3.2 | 0.39 | 0.12 |
下列说法不正确的是
A. 根据平衡常数随温度的变化关系,判断出ΔH<0
B. 保持其他条件不变,SO2的平衡转化率α(727℃)<α(927℃)
C. 增大压强、降低温度能提高SO2的转化率
D. SO3的稳定性随温度的升高而降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列热化学方程式
C(s) + O2(g) = CO2(g) △H1=–393.5 kJ·mol-1
2H2(g) + O2(g) =2H2O(l) △H2=–571.6 kJ·mol-1
CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3 kJ·mol-1
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
A. △H=+244.1 kJ·mol-1B. △H=-488.3 kJ·mol-1
C. △H=-996.6 kJ·mol-1D. △H=+996.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的。请回答下列问题:

(1)描述D在元素周期表中的位置:_____________________________。
(2)在A、B、C、E四种元素最高价氧化物对应的水化物中酸性最强的是__________(写化学式,下同),非金属最简单气态氢化物最不稳定的是_____________________。
(3)写出满足下列条件分子的结构式_________________________
①所有原子最外层是8个电子; ②C和E组成的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnSO4·7H2O和CuSO4·5H2O的部分实验步骤如下:
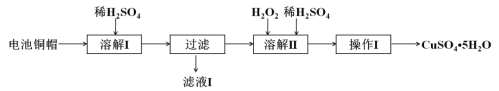
(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是___________、____________。
(2) 从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为__________、__________、过滤、冰水洗涤、低温干燥。
(3)在“溶解II”步骤中,发生反应的离子方程式为____________________________。
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol·L-1Na2S2O3溶液至刚好完全反应,消耗Na2S2O3溶液25.00mL。已知:2Cu2++4I-===2CuI(白色)↓+I2, 2S2O32-+I2===2I-+S4O62- 请依据实验数据计算样品中CuSO4·5H2O的质量分数(写出计算过程)_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com