
【题目】根据下列热化学方程式
C(s) + O2(g) = CO2(g) △H1=–393.5 kJ·mol-1
2H2(g) + O2(g) =2H2O(l) △H2=–571.6 kJ·mol-1
CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3 kJ·mol-1
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
A. △H=+244.1 kJ·mol-1B. △H=-488.3 kJ·mol-1
C. △H=-996.6 kJ·mol-1D. △H=+996.6 kJ·mol-1
【答案】B
【解析】
依据热化学方程式和盖斯定律计算分析,反应的焓变与反应过程无关,只与起始状态和终了状态有关,据此分析。
已知 ①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+![]() O2(g)═H2O(l)△H2=-285.8kJ/mol
O2(g)═H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据盖斯定律(1)×2-(3)+(2)×2得到2C(s) + 2H2(g)+ O2(g)=CH3COOH(l) △H=(393.5kJ/mol)×2(870.3kJ/mol)+(285.8kJ/mol)×2=488.3kJ/mol,B项正确,
答案选B。


科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL、2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
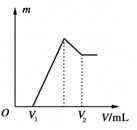
(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如上图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL、2 mol·L-1的H2SO4溶解此混合物后,再加入450 mL、1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 硅和C60的熔化克服相同类型作用力
B. 只有活泼金属元素与活泼非金属元素之间才能形成离子键
C. 等物质的量的CN-和N2含有的共用电子对数相等
D. 氯气与NaOH溶液反应的过程中,同时有离子键、极性键与非极性键的断裂和形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合动力汽车(HEV) 中使用了镍氢电池,其工作原理如图所示:其中M 为储氢合金,MH 为吸附了氢原子的储氢合金,KOH 溶液作电解液。关于镍氢电池,下列说法不正确的是

A. 充电时,阴极附近pH 降低
B. 电动机工作时溶液中OH-向甲移动
C. 放电时正极反应式为:NiOOH+H2O+e- =Ni(OH)2+OH-
D. 电极总反应式为:MH+NiOOH![]() M+Ni(OH)2
M+Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ/moL、497kJ/mol。N2 (g)+ O2 (g)=2NO(g) H=+180.0kJ/moL。则相同条件下破坏1molNO中化学键需要吸收的能量为_____kJ.
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=_____mol/L。
若加入少量NaOH固体,则溶液中![]() _____(填"增大”、“减小”或“不变”)。
_____(填"增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(ψ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32- ____(填“能”或“不能”)大量共存。
②pH=12时,Na2CO3溶液中物料守恒关系为______。当pH=7时,溶液中含碳元素的微粒主要为_________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=_____。
HCO3-+OH-的平衡常数Kh=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液pH、n[Al(OH)3]随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法不正确的是
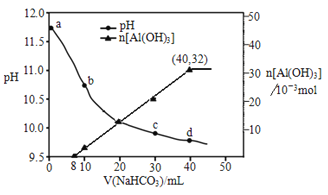
A. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
B. b 点与c点溶液所含微粒种类相同
C. a 点溶液中大量存在的离子是Na+、AlO2-、OH-
D. NaHCO3溶液的物质的量浓度为0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置进行化学反应X+Y===M+N能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处升、乙处降。关于该反应的下列叙述正确的是
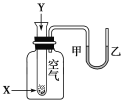
A. X的能量一定低于M的,Y的能量一定低于N的
B. 该反应为吸热反应,一定要加热反应才能进行
C. X和Y的总能量一定低于M和N的总能量
D. 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,针对图像下列分析不正确的是
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,针对图像下列分析不正确的是
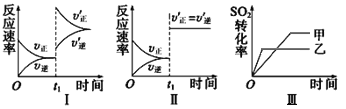
A.图Ⅰ研究的是t1时刻增大压强(缩小体积)对反应速率的影响
B.图Ⅱ研究的是t1时刻通入氦气(保持恒容)对反应速率的影响
C.图Ⅱ研究的是t1时刻加入正催化剂对反应速率的影响
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com