
����Ŀ����֪��2SO2 (g)+ O2(g) ![]() 2SO3(g) ��H���й��������£�
2SO3(g) ��H���й��������£�
T������ | 527 | 627 | 727 | 827 | 927 |
ƽ�ⳣ��K | 910 | 42 | 3.2 | 0.39 | 0.12 |
����˵������ȷ����
A. ����ƽ�ⳣ�����¶ȵı仯��ϵ���жϳ���H��0
B. ���������������䣬SO2��ƽ��ת������(727��)����(927��)
C. ����ѹǿ�������¶������SO2��ת����
D. SO3���ȶ������¶ȵ����߶�����
���𰸡�B
��������
A�����ݱ������ݣ��¶����ߣ�ƽ�ⳣ��K�ڼ�С��˵���÷�Ӧ�������Ƿ��ȷ�Ӧ����H��0����A��ȷ��B��ƽ�ⳣ��������Ӧ���еij̶ȴ�С��KԽ��Ӧ���еij̶�Խ��Ӧ���ת����Խ�ߣ�727����K=3.2��927����K=0.12������SO2��ƽ��ת������(727��)����(927��)����B����C.2SO2(g)+O2(g)2SO3(g)��H��0�������������������С�ķ�Ӧ���Ƿ��ȷ�Ӧ����������ѹǿ�������¶ȣ���ʹƽ�������ƶ��������SO2��ת���ʣ���C��ȷ��D����������Խ��Խ�ȶ������¶����ߣ�����������������ȶ��Ա�����SO3���ȶ������¶ȵ����߶����ͣ���D��ȷ����ѡB��


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����(S2Cl2)�ڹ�ҵ����������Ϊ��ʵ���Һϳ�S2Cl2��ij��ѧ�о���ѧϰС��������й����ϣ��õ�������Ϣ��
�ٽ����﴿����������110�桫140������Ӧ�����ɵ�S2Cl2��Ʒ��
���й����ʵIJ����������±���
���� | �۵�/�� | �е�/�� | ��ѧ���� |
S | 112.8 | 444.6 | �� |
S2Cl2 | ��77 | 137 | �������������S2Cl2��Cl2 |
���ʵ��װ��ͼ���£�

(1)����A��������______________��
B�з�Ӧ�����ӷ���ʽΪ_________________________________��
(2) S2Cl2��ˮ�����ɻ�ɫ���ʡ�һ����ʹƷ����Һ��ɫ�����廯���P������D�е��Լ�Ӧ��________��д���÷�Ӧ�Ļ�ѧ����ʽ__________________ ��
(3)װ��H��������_______________ �����з�����Ӧ�Ļ�ѧ����ʽΪ ______________________��
(4)S2Cl2��Ʒ�п��ܻ��е�������SCl2��Cl2��S,Ϊ�����S2Cl2�Ĵ��ȣ��ؼ��IJ����ǿ��ƺ��¶Ⱥ�_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��״���£�22.4L�����������ļ��Թ��ۼ���ĿΪNA
B. 500C��101KPaʱ3.2gSO2��������O2��ַ�Ӧ������SO3����ĿΪ0.05NA
C. 100mL12mol/L��Ũ���������ͭ��Ӧ��ת�Ƶĵ���������0.6NA��0.9NA֮��
D. 1L0.1mol/LNH4Cl��Һ�У�NH4+������Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڽ����к��ȵIJⶨʱ�����в���������ǣ� ��
A.��Ӧǰ�ᡢ����Һ���¶�Ҫ��ͬ
B.Ϊ��ʹ��Ӧ���Ƚ��У������ᣨ��зִμ����ᣩ
C.������Һ���¶ȼ�Ҫһֱ������Һ��
D.Ϊ��ʹ��Ӧ����ȫ������ʹ�����ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ���C60���ۻ��˷���ͬ����������
B. ֻ�л��ý���Ԫ������÷ǽ���Ԫ��֮������γ����Ӽ�
C. �����ʵ�����CN-��N2���еĹ��õ��Ӷ������
D. ������NaOH��Һ��Ӧ�Ĺ����У�ͬʱ�����Ӽ������Լ���Ǽ��Լ��Ķ��Ѻ��γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ƬͶ��������Һ����Һ�������ӣ���������������ǣ�
A.����B.CuSO4��ҺC.ϡ����D.FeCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش���������:
(1)��֪��N2��O2�����л�ѧ���ļ��ֱܷ���946kJ/moL��497kJ/mol��N2 (g)+ O2 (g)=2NO(g) H=+180.0kJ/moL������ͬ�������ƻ�1molNO�л�ѧ����Ҫ���յ�����Ϊ_____kJ.
(2)25��ʱ��pH=5��CH3COOH��Һ�У���ˮ�������������Ũ��c(H+)=_____mol/L��
����������NaOH���壬����Һ��![]() _____(��"��������С�����䡱)��
_____(��"��������С�����䡱)��
(3)25����,��ijNa2CO3��Һ�м���ϡ���ᣬ�京̼Ԫ�ص������ʵ�������(��)����ҺpH�仯�IJ��������ͼ��ʾ��

����ͬһ��Һ�У�H2CO3��HCO3-��CO32- ____(��ܡ����ܡ�)�������档
��pH=12ʱ��Na2CO3��Һ�������غ��ϵΪ______����pH=7ʱ����Һ�к�̼Ԫ�ص�����ҪΪ_________��
�۷�Ӧ��CO32-+H2O![]() HCO3-+OH-��ƽ�ⳣ��Kh=_____��
HCO3-+OH-��ƽ�ⳣ��Kh=_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧһѡ��3:���ʽṹ�����ʣ�1735����仯ѧ�Ҳ�����(G��Brands)�Ƴ������ܡ��ܵĿ�����ܵĻ�����һֱ�����մɡ����������ŵ����ϡ���20���ͣ��ܼ���Ͻ��ڵ������е�����������պͺ���ȹ�ҵ���ŵõ��㷺��Ӧ�ã�����Ϊһ����Ҫ��ս�Խ����������ܼ��仯���������Ҫ���ã��ش���������:
(1)��̬Coԭ�ӵĵ����Ų�ʽΪ___________��
(2)[Co(NH3)5H2O]Cl3��һ��ש��ɫ�ľ��壬��ͨ��CoCl2��NH4Cl��Ũ��ˮ��H2O2�Ƶá�
��Co��N��0ԭ�ӵĵ�һ�������ɴ�С��˳����__________��
��[Co(NH3)5H2O]Cl3��CoԪ�ػ��ϼ�Ϊ____������λԭ��Ϊ_____��1mol�þ����к���____mol�Ҽ���
��H2O2��Oԭ�ӵ��ӻ����������______��H2O2����ˮ���ܣ������Ǽ��Է����⣬����Ϊ____��
��NH3��NF3�Ŀռ乹�Ͷ���ͬ,��Co3+����NH3�γ������ӣ���NF3���ܡ�ԭ����________��
(3)CoO������ͼ����֪Coԭ�Ӱ뾶Ϊapm,Oԭ�Ӱ뾶Ϊbpm����Ⱦ����������Oԭ��Χ�ɵĿռ���״Ϊ_____���þ�����ԭ�ӵĿռ�������Ϊ__________(�ú�a��b�ļ���ʽ��ʾ)��
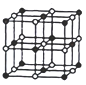
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�г�������ͼ����һ�����ֶ���������ͻ��ʵ��װ�õ�Ҫ�㣬����ز�����ѧ���̵�ԭ���� �����йػ�ѧͼ����ֵ�������ȷ����
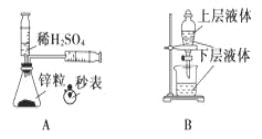
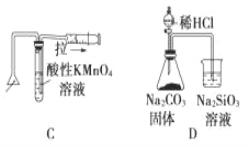
A. �ⶨһ��ʱ�������� H2 �ķ�Ӧ���� B. ��ȡ�����еĵ�
C. ������ȼ�ղ����� SO2 D. ֤���ǽ����ԣ�Cl>C>Si
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com